
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤取滤液;③蒸发滤液;④冷却结晶。
(1)在操作①、②、③中均用到玻璃棒,该仪器的目的依次是 、 、 。
(2)为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等份:
①取一份溶液,加入适量HCl,观察到 ,证明含有碳酸根。
②取另一份溶液,为检验SO42-,应往溶液中加入 。
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl-。你认为该生所得的结论是否严密? 。为什么? 。
(1)加速溶解;引流;受热均匀(防止液体飞溅)
(2) ①有气泡产生 ②盐酸酸化的氯化钡 ③不严密;碳酸根,硫酸根也会与银离子反应产生沉淀。
解析试题分析:(1)在溶解固体时,使用玻璃棒可以加速溶解;在过滤操作中,可以用玻璃棒引流;在蒸发结晶操作时,用玻璃棒进行搅拌,可使液体受热均匀(防止液体飞溅)。(2)①CO32-能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡产生说明有CO32-;②向原溶液中滴加盐酸酸化的氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有SO42-;③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有Cl-。
考点:考查物质分离与提纯的方法及常见阴离子的检验。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
制备水杨酸对正辛基苯基酯(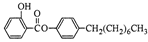 )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图12所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯,该反应为: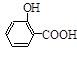 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→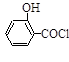 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[ ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5 |
| PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
将一定量铁粒放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。
(1)为探究溶液X中铁元素的价态,设计如下实验:
药品和仪器:0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性高锰酸钾溶液、氯水、试管和滴管。
请根据实验设计,填写下列实验报告:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | | |
| 第2步 | | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
富马酸亚铁(分子式为C4H2O4Fe,结构简式为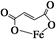 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图: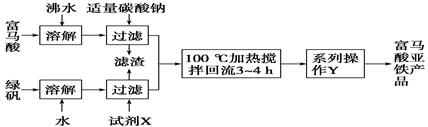
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究。请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→_______、_______→_______、_______→_______;其中广口瓶Ⅱ中的试剂为_______。

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_______;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2。请设计实验,探究该样品中除CaCl2外还含有的其他固体物质。
①提出合理假设。
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有______;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1 mol·L-1 HCl溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-。)
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取少量上述漂白粉于试管中,先加入 溶解后,再把生成的气体通入 。 | 若 ,则假设1成立; 若 ,则假设2或假设3成立。 |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1 mol·L-1 HCl溶液,再加入 。 | 若 ,则假设2成立; 若 ,则假设3成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |

 转化为MgCl2的离子方程式是________________________________。
转化为MgCl2的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)方案更合理,理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al203、Fe及其他不溶于酸、碱的杂质。部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
欲从含镍废催化剂中制得NiSO4·7H2O晶体,其流程如下:
请根据以上信息和流程图,回答下列问题:
(1)“碱浸”的目的是除去含镍废催化剂中的___ _。
(2)“酸浸”时所加入的酸是___ _。酸浸后,滤液②中可能含有的金属离子是___ 。(用离子符号表示)。
(3)“调pH为2—3的目的是___ _。
(4)步骤A的操作顺序是加热浓缩、冷却、____、____。
(5)NiSO4在强碱溶液中用NaC1O氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com