
【题目】![]() 时,有
时,有![]() 的一组醋酸和醋酸钠的混合溶液,溶液中
的一组醋酸和醋酸钠的混合溶液,溶液中![]() 、
、![]() 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是 ![]()
![]()

A.![]() 的溶液中:
的溶液中:![]()
B.该温度下醋酸的电离平衡常数为![]()
C.![]() 的溶液中:
的溶液中:![]()
D.向W点所表示的溶液中加入等体积的![]() 溶液:
溶液:![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________。
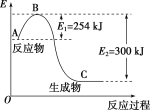
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及(1)的图中数据计算N—H键的键能为________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.0100mol/L苯酚(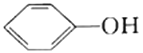 )溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
)溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
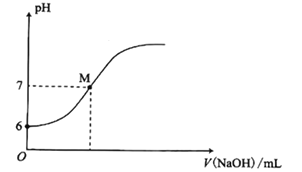
A. 25℃时,苯酚的电离常数Ka约为1.0×10-4
B. M点时,所加人NaOH溶液的体积大于10mL
C. M点时,溶液中的水不发生电离
D. 加入20mLNaOH溶液时,溶液中c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )
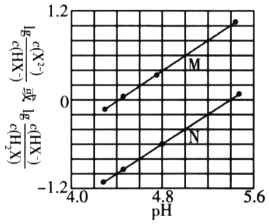
A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物的部分结构如下:是由许多分子中含双键的物质M相互加成而得,下列说法正确的是( )
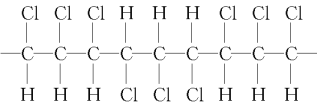
A.该高分子化合物的链节为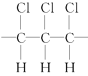
B.该化合物的分子式是C3H3Cl3
C.形成该化合物的单体是CHCl=CHCl
D.该化合物的结构简式可写为CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对可逆反应:2NO2 (g)![]() 2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是
2NO(g) +O2 (g)ΔH=- 1162kJ·mol-1 的影响,若保持气体的总质量不变,在温度为 T1、T2 时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是

A.a、c 两点混合气体的平均相对分子质量:Ma>Mc
B.b、c 两点的平衡常数:Kb=Kc
C.从状态a 到状态c,NO2 气体的转化率减小
D.T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。

完成下列填空:
(1)A的名称是_______,反应③的反应类型是_____。
(2)写出反应②的化学反应方程式_____。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式_____。鉴别这两个环状化合物的试剂为_______。
(4)以下是由A制备工程塑料PB的原料之一1,4-丁二醇(BDO)的合成路线:
![]()
写出上述由A制备BDO的化学反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。

(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭![]() 足量
足量![]() 和NO,发生反应:
和NO,发生反应:![]()
![]()
![]() △H<0,NO和
△H<0,NO和![]() 的物质的量变化如下表所示。
的物质的量变化如下表所示。
物质的量 |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1℃温度下,反应进行了![]() ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率![]() ______。已知:气体分压
______。已知:气体分压![]() 气体总压
气体总压![]() 体积分数。
体积分数。![]() 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数![]() ______。
______。
![]() 第
第![]() 后,温度调整到
后,温度调整到![]() ,数据变化如上表所示,则
,数据变化如上表所示,则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)若30min时,保持![]() 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各![]() ,则此时反应______移动
,则此时反应______移动![]() 填“正向”“逆向”或“不”
填“正向”“逆向”或“不”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com