
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
|


科目:高中化学 来源: 题型:
| A | B | C | |
| D | E |
| A、A与B形成的微粒可能有:AB32-、AB2 |
| B、E的氢化物的沸点比C的氢化物的沸点高 |
| C、D在过量的B中燃烧的主要产物为DB2 |
| D、C、B、A的氢化物稳定性依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| CH4 | C2H4 | C3H8O | C5H10 | C6H14O | C7H16 | C8H16 | C9H20O |
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4 |
| B、Na2CO3 |
| C、Cu2O |
| D、Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
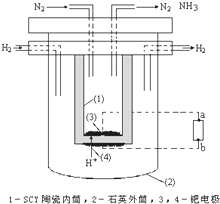 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- x |
- 3 |
2- 4 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com