
【题目】Ⅰ.现有各组物质:①O2和O3 ②![]() 和
和![]() ③
③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤  ⑥
⑥ ![]() 和质量数为238、中子数为146的原子 ⑦
和质量数为238、中子数为146的原子 ⑦![]()
请按要求用序号填空:
(1)属于同系物的是___________(2)属于同分异构体是_________(3)属于同位素的是_________(4)属于同素异形体的是________(5)属于同种物质的是___________
II.命名或写出结构简式:
(1) 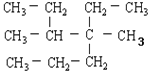 ________________________________
________________________________
(2)2-乙基-1-戊烯 _______________________________
(3)支链上只有一个乙基,且式量最小的烷烃 _________________
【答案】 ④ ⑦ ⑥ ① ⑤ 3,4﹣二甲基﹣4﹣乙基庚烷 CH2=C(CH2CH3)CH2CH2CH3 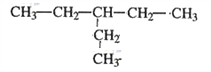
【解析】Ⅰ、同系物是指结构相似,组成上相差1个或者若干个CH2原子团的化合物。具有相同分子式而结构不同的化合物互为同分异构体;质子数相同质量数(或中子数)不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;
①O2和O3是由氧元素组成的不同单质,互为同素异形体;②CH2=CH-CH3和CH2=CH-CH=CH2的结构不同,分子式也不同;③![]() 和
和![]() 分子式不同,结构也不同;④
分子式不同,结构也不同;④![]() 和
和![]() 的结构相似,组成上相差2个CH2,属于同系物;⑤
的结构相似,组成上相差2个CH2,属于同系物;⑤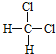 和
和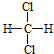 组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与
组成和结构都相同,为同一物质;⑥质量数为238,中子数为146的原子其质子数为238-146=92,与![]() 的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
的质子数相同,质量数(或中子数)不同,互称同位素;⑦C2H5C=C=CH2和CH3CH=CHCH=CH2具有相同分子式而结构不同,属于同分异构体。
故答案为:(1)④;(2)⑦;(3)⑥;(4)①;(5)⑤。
II、(1)烷烃命名时,选最长碳链为主链,从支链最近的一端进行编号;该物质最长碳链含有七个碳,2个-CH3分别在3、4号位,1个乙基在4号位,故命名为:3,4﹣二甲基﹣4﹣乙基庚烷;
(2)2-乙基-1-戊烯,含碳碳双键在内最长碳链有5个碳原子,离双键最近的一端编号,碳碳双键在1号碳,2号碳有一个乙基,据此写出结构简式:CH2=C(CH2CH3)CH2CH2CH3;
(3)支链的长度不能超过其所在位置两侧的主链的长度,烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为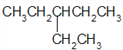 。
。
【题型】综合题
【结束】
24
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列关于乙醛的说法错误的是( )
A. 一个乙醛子有6个σ键,1个π键
B. 乙醛分子中存在非极性键
C. 乙醛在催化剂铜存在下可以氧化生成乙醇
D. 乙醛晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )
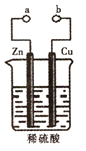
A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只要用一种试剂,可区别NaCl、MgSO4、FeCl2、FeCl3四种溶液,这种试剂是( )
A.HCl
B.NaOH
C.AgNO3
D.BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.
【题型】综合题
【结束】
25
【题目】(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________.
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。

②由图可得Fe(OH)2的溶度积的值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图表示的是pH对植物和人的淀粉酶活性的影响;乙图表示的是3种脱氢酶(A、B、C)的活性受温度影响的情况。下列叙述正确的是( )

A. 从甲图中可以知道pH=6时植物淀粉酶的活性最高
B. 从乙图中无法知道酶C的最适温度
C. 从甲图中可以知道若细胞由酸性变成碱性时,淀粉酶的活性逐渐升高
D. 从乙图中可以知道酶活性温度范围最广的是B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的CH2ClCH2Cl(即1,2-二氯乙烷),可采取的方法是
A.乙烯与Cl2加成
B.乙烯与HCl加成
C.乙烷与Cl2按1∶2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com