
����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1��Al��NO3��3���Ʊ������ز�����ԭ��֮һ������Al��NO3��3�������ջ����е�ˮ�֣������Ҫ������ж������������岽����ͼ��ʾ�� 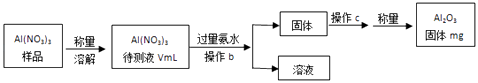
�ټ��������ˮ������Ӧ�����ӷ���ʽΪ�� ��
�ڲ���bΪ��
��Al��NO3��3����Һ�У�c��Al3+��=mol/L���ú�m��V�Ĵ���ʽ��ʾ����
��2�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ�� 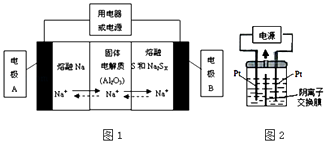
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050�� |
�е�/�� | 892 | 444.6 | 2980 |
�ٸ��ݱ����ݣ������жϸõ�ع���������Ӧ������������ĸ����Χ�ڣ�
A.100������ B.100��300��C.300��350��D.350��2050��
�ڷŵ�ʱ���缫AΪ�����缫B������Ӧ���������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX�T2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ�� ��
��3��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ�����Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ� ��
���𰸡�
��1��Al3++3NH3?H2O�TAl��OH��3��+3NH4+�����ˣ�![]()
��2��C��������ԭ��Sx2����2e���TxS
��3��2H2O+2e��=H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ
���������⣺��1�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �Լ�aΪ��ˮ����Ӧ�ķ���ʽΪAl3++3NH3H2O�TAl��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O�TAl��OH��3��+3NH4+�����ɲ������̿�֪ʵ��ԭ����Al��NO3��3�Ͱ�ˮ��Ӧ����Al��OH��3 �� �����˵õ�Al��OH��3���壬���Բ���bΪ���ˣ����Դ��ǣ����ˣ���n��Al2O3��= ![]() =
= ![]() mol����n��Al��NO3��3��=2n��Al2O3��=
mol����n��Al��NO3��3��=2n��Al2O3��= ![]() mol�� c��Al��NO3��3��=
mol�� c��Al��NO3��3��= ![]() =
= ![]() mol/L�����Դ��ǣ�
mol/L�����Դ��ǣ� ![]() ����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��
����2����ԭ��ع���ʱ�����Ƶ��¶�ӦΪ����Na��SΪ����״̬�����¶�Ӧ����115�������444.6�棬ֻ��C���ϣ����Դ��ǣ�C���ڷŵ�ʱ��Na����������AӦΪԭ��ظ�����BΪ����������ԭ��Ӧ�����Դ��ǣ�������ԭ���۳��ʱ���ǵ��ط�Ӧ��������ӦΪ��Sx2����2e��=xS�����Դ��ǣ�Sx2����2e���TxS����3���������Ϸ����������Һ����ɫ������I2 �� ���缫Ϊ�������缫��ӦΪ��2I����2e��=I2 �� �Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH�� �� �Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ���������Ӧ3I2+6OH��=IO3��+5I��+3H2O��һ��ʱ�����ɫ��dz�����Դ��ǣ�2H2O+2e��= H2��+2OH�����Ҳ���Һ�����ɵ�OH��ͨ�������ӽ���Ĥ���������Һ�����������Һ��I2��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���������о�����ͬһ��Ԫ�أ�����֮�������ͼ��ʾ��ת����ϵ�����ַ�Ӧ������ȥ���� 
��ش��������⣺
��1����A��һ�ֽ��������B��C��Ϊ������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ���д����Ӧ�ٺͷ�Ӧ�ܣ�A��һ��ת��ΪB��C�������ӷ���ʽ����Ӧ�� �� ��Ӧ��
��2������Ӧ��Ϊ�û���Ӧ����Ӧ��Ϊ���Ϸ�Ӧ��C���ʴ��������ں�ˮ�У����������������ȱ�ٵ����ʣ���ҵ�Ͽ�����C����ȡA��B����д����������Ӧ�Ļ�ѧ����ʽ��C��A��C��B ��
��3������Ӧ�٢ڢ۾�Ϊ���Ϸ�Ӧ����Ӧ��Ϊ�û���Ӧ����AΪһ�ֽ�������ʱ����д����Ӧ�ں͢ۿ��ܵ����ӷ���ʽ����Ӧ�ڣ�����Ӧ�ۣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״����CH4��HCl��H2S��NH3��Ϊ���壮�ڱ�״���·ֱ��Т�13.44L CH4��1molHCl���� ��27.2gH2S ��2.408��1023��NH3���ӣ�����˵����ȷ���ǣ�������
A.������ڣ��ۣ��ܣ���
B.�ܶȣ��ڣ��ۣ��٣���
C.�������ڣ��ۣ��ܣ���
D.Hԭ�Ӹ������٣��ۣ��ܣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���£� ![]() ������Ϊ�����������ȼ�ϣ�NH3��NaClO��Ӧ�ɵõ��£�
������Ϊ�����������ȼ�ϣ�NH3��NaClO��Ӧ�ɵõ��£�
��1��ʵ�������Ȼ�狀����������Ʊ������Ļ�ѧ����ʽ��
��2����֪����N2��g��+2O2��g��=N2O4��l����H1=��195kJmol��1
��N2H4��l��+O2��g��=N2��g��+2H2O��g����H2=��534kJmol��1
д��Һ̬�º�N2O4��l����Ӧ����N2��ˮ�������Ȼ�ѧ����ʽ��
��3����֪����1mol��ѧ�������������kJ�����£�N��NΪ942��O=OΪ498��N��NΪ154��H��OΪ464�������N2H4��l��+O2��g��=N2��g��+2H2O��g����H2=��534kJmol��1�����ݼ������1molN��H�������������kJ���ǣ�
��4��д��NH3��NaClO��Ӧ�õ��µĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25gmL��1����������Ϊ36.5%��Ũ��������240mL 0.1molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ ��
��2������ 240mL 0.1molL��1 ������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
��3������ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�� �� ��
A.��30mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B.����Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ���Ͼ���
C.������ȴ�������ز�����ע������ƿ��
D.������ƿ�ǽ�����ҡ��
E.���ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12cm��
��4����ʵ�������������������������Һ�����ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ�����ƫ�͡����䡱����
������ϡ��������ձ�δϴ�ӣ� ��
������ƿ��ԭ����������ˮ�� ��
�۶���ʱ�۲�Һ�温�ӣ� ��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶� ��
��������ƿ��ת����Һʱ�й�Һ��������Һ���� ��
�۶���ҡ�����Һ���½� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����H��0�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������ǣ� ��
ѡ�� | x | y |
A | MgSO4����������������� | CO��ת���� |
B | CO�����ʵ��� | CO2��CO�����ʵ���֮�� |
C | SO2��Ũ�� | ƽ�ⳣ��K |
D | �¶� | �����ڻ��������ܶ� |

A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������ķ�������ͬ���ǣ�������
A.10g H2��10g O2
B.5.6L N2��0.25mol CO2
C.0.5 NA��H2O��0.5mol I2
D.32g O2��32g O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з������淴Ӧ4NH3��g��+5O2��g��4NO��g��+6H2O��g���������Dz�ͬ����µķ�Ӧ���ʣ����������ǣ� ��
A.v��O2��=0.01 molL��1s��1
B.v��NH3��=0.02molL��1s��1
C.v��H2O��=0.06 molL��1min��1
D.v��NO��=0.03molL��1s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ���Cr������Һ����Ҫ��Cr3+������ɫ����Cr��OH��4������ɫ����Cr2O72�����Ⱥ�ɫ����CrO42������ɫ������ʽ���ڣ�Cr��OH��3Ϊ������ˮ�Ļ���ɫ���壬�ش�
��1��Cr3+��Al3+�Ļ�ѧ�������ƣ���Cr2��SO4��3��Һ�е���NaOH��Һֱ���������ɹ۲쵽�������� ��
��2��CrO42����Cr2O72������Һ�п��ת���������£���ʼŨ��Ϊ1.0molL��1��Na2CrO4��Һ��c��Cr2O72������c��H+���ı仯��ͼ��ʾ�� 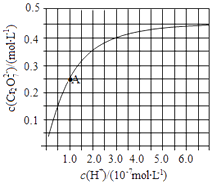
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ ��
����ͼ��֪����Һ������ǿ��CrO42����ƽ��ת�����������С�����䡱����
����A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ ��
��3����K2CrO4Ϊָʾ������AgNO3��Һ�ζ���Һ�е�Cl�� �� Ag+��CrO42������ש��ɫ����ʱ����ζ��յ㣮����Һ��Cl��ǡ����ȫ������Ũ�ȵ���1.0��10��5molL��1��ʱ����Һ��c ��Ag+��ΪmolL��1 �� ��ʱ��Һ��c��CrO42��������molL��1 �� ��Ksp��Ag2CrO4��=2.0��10��12��Ksp��AgCl��=2.0��10��10����
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72����ԭ��Cr3+ �� ��Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com