
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |

A.A
B.B
C.C
D.D
【答案】D
【解析】解:该反应是一个反应前后气体体积增大的吸热反应,
A.若x是MgSO4的质量,y是CO的转化率,硫酸镁是固体,其质量不影响平衡移动,所以增大硫酸镁的质量,CO的转化率不变,故A错误;
B.若x是CO的物质的量,y是CO2与CO的物质的量之比,增大CO的物质的量,平衡向正反应方向移动,但加入的CO量大于CO转化的量,所以增大CO的物质的量,CO2与CO的物质的量之比应该减小,故B错误;
C.若x是二氧化硫的浓度,y是平衡常数,平衡常数只与温度有关,与物质浓度无关,增大二氧化硫浓度,温度不变,平衡常数不变,故C错误;
D.若x是温度,y是容器内混合气体的密度,升高温度,平衡向吸热反应方向正反应方向移动,气体的质量增大,容器体积不变,则容器内气体密度增大,所以符合图象,故D正确;
故选D.
该反应是一个反应前后气体体积增大的吸热反应,
A.若x是MgSO4的质量,y是CO的转化率,硫酸镁是固体,其质量不影响平衡移动;
B.若x是CO的物质的量,y是CO2与CO的物质的量之比,增大CO的物质的量,平衡向正反应方向移动,但加入的CO量大于CO转化的量;
C.若x是二氧化硫的浓度,y是平衡常数,平衡常数只与温度有关,与物质浓度无关;
D.若x是温度,y是容器内混合气体的密度,升高温度,平衡向吸热反应方向移动.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂﹣KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e﹣=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )
A.①②
B.①②④
C.②③
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( ) 
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
C.M点的正反应速率V正大于N点的逆反应速率V逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 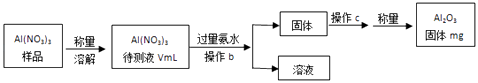
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 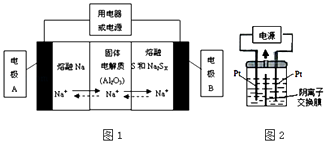
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,若VL甲烷(CH4)中含有的氢原子个数为n,则阿伏加德罗常数可表示为 ( )
A. Vn/22.4 B. 22.4n/V
C. Vn/5.6 D. 5.6n/V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是
A.CrO3+NH3+H2O
B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O
D.Cr2O3+N2+H2O
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3 , KMnO4被还原成Mn2+ , 该反应的离子方程式为
(3)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯.其变化可表述为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
a.请分析该反应中电子转移的情况(单线桥法表示): .
b.还原剂与还原产物的物质的量之比为 .
c.浓盐酸在反应中显示出来的性质是 . (填写编号)
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性.
d.产生0.1mol Cl2 , 则转移的电子的物质的量为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com