
【题目】现有部分前四周期元素的性质或原子结构如下表:

(1)B单质分子中,含有________个![]() 键和__________个
键和__________个![]() 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
【答案】1 2 三角锥形 低于 Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高 1s22s22p63s23p63d54s1
【解析】
根据信息A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,得出B为N;同一周期,元素原子对应的第一电离能有增大的趋势,则根据C在第三周期主族元素中其第一电离能最大,推出该元素为Cl;D在前四周期中其未成对电子数最多,所以为Cr。
A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,即电子排布式为1s22s22p3,得出B为N元素;C在第三周期主族元素中其第一电离能最大,为Cl;D在前四周期呀中其未成对电子数最多,即M层d能级半满,N层s能级半满,即电子排布式为1s22s22p63s23p63d54s1,所以该元素为Cr。
(1)B单质分子为氮气,分子内为氮氮三键,则含有1个![]() 键和2个
键和2个![]() 键;其气态氢化物为NH3,空间构型为三角锥形,
键;其气态氢化物为NH3,空间构型为三角锥形,
故答案为:1;2;三角锥形;
(2)C单质为Cl2,其晶体类型为分子晶体;A单质为Si,其晶体属于原子晶体,因原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,所以C单质(Cl2)的熔点低于A单质(Si)的熔点,
故答案为:低于;Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高;
(3)D在前四周期中,其未成对电子数最多,即M层d能级半满,N层s能级半满,即其基态原子的电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】有四种微粒的结构示意如下,下列说法错误的是( )
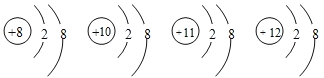
A.它们属于不同种元素
B.它们的核外电子排布相同
C.它们都是离子
D.它们都具有稀有气体原子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在人类的生活生产中有着重要的作用,Fe2+、Fe3+是影响水质的一个重要因素。回答下列问题:
I:测量某河水样本中铁的含量
(1)水样中Fe2+的含量越大,溶解氧的含量就越低,用离子方程式解释原因___________。
(2)测定Fe2+取5mL c mo/L的KMnO4标准液,稀释至100mL。取10.00mL河水水样,加入稀硫酸后,用稀释后的KMnO4溶液进行滴定,用去KMnO4溶液V1mL。
①用___________(填滴定管的名称)盛放KMnO4标准液。
②滴定达到终点的标志是___________。
(3)测定Fe3+:取10.00mL水样,转移至盛有过量锌粒的烧杯中充分反应。加入过量稀硫酸,用表面皿盖住烧杯并加热10分钟。冷却后用(2)中稀释后的KMnO4溶液滴定,消耗KMnO4溶液V2mL。
①锌粒的作用是___________。
②河水中Fe3+的浓度是___________mol/L(用含字母的代数式表示)。
Ⅱ:氢氧化亚铁[Fe(OH)2]在常温常压下为白色固体。
(4)当溶液中的离子浓度<1×10-5mol·L-1时,可以认为该离子已沉淀完全。已知常温Fe(OH)2的Ksp为8.0×10-16。现调节含Fe2+的某河水样品pH=9,用简要计算过程说明Fe2+是否已经达到沉淀完全:___________。
(5)一种用Na2SO4溶液做电解液,电解制取Fe(OH)2的实验装置如图所示。通电后,溶液中产生白色沉淀,且较长时间不变色。

①必须使用铁电极的是___________(填“A"或“B”)极。
②B电极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示

(1)溴化钠晶体比氯化钠晶体晶格能________(填“大”或“小”),主要原因是_____。
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是_________________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是________。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
A.ν(H2O)=0.6 mol/(L·s)B.ν(O2)=0.72 mol/(L·s)
C.ν(NO)==0.9 mol/(L·s)D.ν(NH3)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
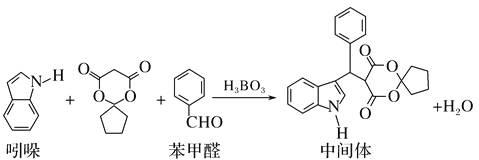
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氨酸(HN3)及其盐(NaN3、NH4N3、CuN3等) 都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)3 (NH4)4Cl。回答问题:
(1) PHAC中“N3”的化合价为_____________,N2F2的电子式为_____________。
(2)汽车安全气囊中NaN3可发生下列反应:
NaN3(s)=Na(s)+![]() N2(g) △H1
N2(g) △H1
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H2
则反应CuO(s)+2Na(s)= Na2O(s)+ Cu(s) △H=_______(用△H1和△H2表示)
(3) 25℃,将1molNH4N3(s)投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol,则NH4N3的平衡转化率为________,25℃时该反应的平衡常数K=__________。
(4) 氢叠氨酸(HN3)易溶于水,且酸性与醋酸相近。
① HN3在水溶液中的电离方程式为_____________。
② 0.1mol·L-1的HN3溶液与0.1mol·L-1的NaN3等体积混合,混合溶液中各离子浓度有大到小的顺序为_________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq) ![]() 2CuN3(s)+S2-(aq)的平衡常数K=_______________。
2CuN3(s)+S2-(aq)的平衡常数K=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com