
【题目】电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)![]() 2 PbCrO4(s)+2H+(aq) ΔH< 0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
2 PbCrO4(s)+2H+(aq) ΔH< 0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
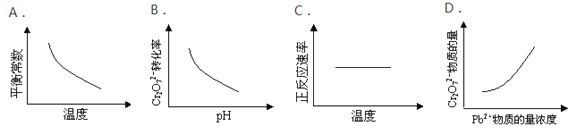
A. A B. B C. C D. D
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,下列溶液中,离子浓度关系正确的是( )
A.pH=a的氨水稀释10倍后,其pH=b,则a=b+1
B. 浓度相同的①NH4Cl ②CH3COONH4
③NH4HSO4,三种溶液中的c(NH![]() ):①>③>②
):①>③>②
C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:
c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.将a mol·L-1 CH3COOH与b mol·L-1 NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态,D和E的反应是化工生产中的一种重要的固氮反应。请回答:

(1)E和F的电子式分别是________和___________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况
_____________________________________________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为________________________________。
(4)标况下3.36L气体B与A完全反应,转移电子的数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)ΔH = +Q kJ·mol-1 (Q >0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
Si(s)+4HCl(g)ΔH = +Q kJ·mol-1 (Q >0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ
C. 将反应的温度由T1升高至T2,则对应温度下的平衡常数K1>K2
D. 当反应吸收热量为0.25Q kJ时,生成的HCl恰好与1 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
(1)Y在元素周期表中的位置为_____________________________.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_____________________(写化学式),非金属气态氢化物还原性最强的是_______________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有__________________(写出其中两种物质的化学式)。
(4)ZX的电子式为_________________;ZX与水反应放出气体的化学方程式为__________________。
(5)用X元素的单质与Y元素的单质及由X、Y、Z三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+;Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序( )
A. Sn4+、Fe3+、Ce4+ B. Sn4+、Ce4+、Fe3+
C. Ce4+、Fe3+、Sn4+ D. Fe3+、Sn4+、Ce4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com