
【题目】如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.装置丙:生成棕色的固体,证明Cl2有强氧化性
D.装置丁:湿润的有色布条褪色,证明Cl2有漂白性
【答案】C
【解析】解:A.浓盐酸与二氧化锰反应需要加热,故A错误;B.氯化氢、氯气能够与碳酸氢钠反应生成二氧化碳,吸收部分氯气同时引入杂质二氧化碳新杂质,故B错误;
C.氯气与铜反应生成氯化铜,氯元素化合价降低,表现氯气的强的氧化性,故C正确;
D.干燥的有色布条不褪色,湿润的有色布条褪色,证明Cl2无漂白性,有漂白性的是次氯酸,故D错误;
故选:C.
【考点精析】本题主要考查了氯气的化学性质和氯气的实验室制法的相关知识点,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能正确解答此题.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列有关煤和石油的加工方法的叙述中错误的是( )
A.通过煤的直接或间接液化可以获得各种芳香烃
B.通过石油的催化重整等工艺可获取芳香烃
C.石油的裂化的目的主要是为了提高轻质油的产量
D.石油的裂解的目的主要是为了获取不饱和烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值.下列说法正确的是( )
A.4.6g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA
B.1 mol Na2O2固体中含离子总数为4NA
C.标准状况下,1.12LCCl4含有C﹣Cl键的数目为0.2NA
D.将0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1NA个Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡是无色液体,熔点﹣33℃,沸点114℃.氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4极易水解,在潮湿的空气中发烟.实验室可以通过图装置制备少量SnCl4 (夹持装置略). 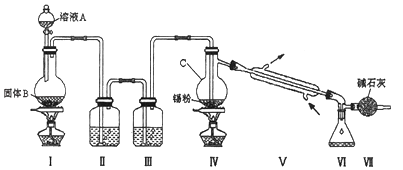
(1)仪器C的名称为:;
(2)装置Ⅰ中发生反应的离子方程式为:;
(3)装置Ⅱ中的最佳试剂为 , 装置Ⅶ的作用为;
(4)若装置连接顺序为Ⅰ﹣Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4外,还会生成的含锡的化合物的化学式为 .
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为;
(6)若Ⅳ中用去锡粉11.9g,反应后,Ⅵ中锥形瓶里收集到23.8g SnCl4 , 则SnCl4的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应速率及化学平衡,下列说法中正确的个数是
①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高,活化分子百分数增加,活化分子浓度也增加,反应速率加快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④3mol·L-1·s-1的反应速率一定比1mol·L-1·s-1的反应速率大
⑤正反应速率越大,反应朝正反应方向进行的程度越大
⑥增加反应物的浓度,活化分子浓度增加,反应速率加快
⑦平衡向正反应方向移动,反应物的转化率都增大
⑧若在一定条件下,平衡向正反应方向移动,则正反应速率变大
⑨化学平衡常数越小,说明正反应进行程度越小,即该反应进行的就越不完全,转化率就 越小
⑩温度越高,化学平衡常数就越大
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2Cl6晶体在常温下就会“升华”,蒸气冷却可得到晶体ICl3。ICl3遇水会产生大量的腐蚀性白色烟雾,有强烈的催泪性。若生成物之一是HCl,则另一种是( )
A.HIO3B.HIO2C.HIOD.ICl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、氧气、KOH 溶液可构成燃料电池提供电能。按要求填写:
(1)该电池总反应的离子方程式为___________________________。
(2)通入甲烷的电极为原电池的________极,该电极反应式为:______________________。
(3)电池工作时,正极区域溶液的pH__________(填“增大、减小或不变”)。
(4) 电路中通过3mol 电子转移时,消耗的氧气体积为(标况)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84gcm﹣3的浓H2SO4来配制500mL0.25mol/L的稀H2SO4 . 可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号).
(2)经计算,需浓H2SO4的体积为 . 现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是(填代号).
(3)将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒 . 转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处.改用加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中:能引起误差偏高的有(填代号).①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com