
| A. | 碱性氧化物 氧化铁 Fe2O3 | B. | 酸性氧化物 干冰 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 碱 纯碱 Na2CO3 |
分析 A.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素;碱性氧化物是能和酸反应生成盐和水的氧化物;
B.酸性氧化物是能和碱反应生成盐和水的氧化物;
C. 酸指电离时所有阳离子都是氢离子的化合物,H2S为氢硫酸;
D.碱指电离时所有阴离子都是氢氧根离子的化合物;盐是指电离出金属阳离子和酸根阴离子的化合物.
解答 解:A.氧化铁化学式为Fe2O3,能和酸反应生成盐和水,属于碱性氧化物,故A正确;
B.二氧化碳的固体是干冰,其化学式是CO2,其名称、俗名与化学式完全相符,故B正确;
C.硫酸(H2SO4)、氢硫酸(H2S)是硫元素的氢化物,故C错误;
D.碳酸钠可以电离出钠离子和酸根阴离子,碳酸钠属于盐,故D错误;
故选AB.
点评 本题考查化学基本概念、物质分类,涉及氧化物、酸、碱、盐等,题目难度不大,注意对概念的理解.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10ml | 20.30ml |
| 第二次 | 0.30ml | 20.10ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(c)=0.2mol/(L•s) | B. | z=3 | ||
| C. | B的转化率为75% | D. | 反应前与2s后容器的压强比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
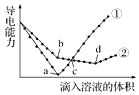 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | c点,两溶液中含有相同量的OH- | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | ①代表滴加H2SO4溶液的变化曲线 | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3C(s)+CaC(s)?CaC2 (s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)△H=-aKJ/mol,平衡时向容器中在充入一定量的NH3,重新达到平衡时a值不变 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g) (△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com