
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是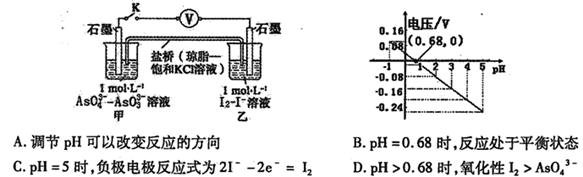
C
解析试题分析:发生AsO43-+2I-+2H+ AsO33-+I2+H2O,为可逆反应,故调节pH(改变H+浓度)可以改变反应的方向,故A正确;根据图示:当pH=0.68时,电压负为0,故反应处于相对静止状态,即化学平衡状态,故B正确;pH=5时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH-
AsO33-+I2+H2O,为可逆反应,故调节pH(改变H+浓度)可以改变反应的方向,故A正确;根据图示:当pH=0.68时,电压负为0,故反应处于相对静止状态,即化学平衡状态,故B正确;pH=5时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH- AsO43-+2I-+H2O,该反应AsO33-发生氧化反应,为负极,故负极反应式AsO33-+H2O-2e-=AsO43-+2H+,故C错误;pH>0.68时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH-
AsO43-+2I-+H2O,该反应AsO33-发生氧化反应,为负极,故负极反应式AsO33-+H2O-2e-=AsO43-+2H+,故C错误;pH>0.68时与pH=0.68时相比,H+浓度减小,平衡向逆反应方向移动,即发生AsO33-+I2+2OH- AsO43-+2I-+H2O,该反应中I2为氧化剂,AsO43-为氧化产物,所以氧化性I2>AsO43-,故D正确。
AsO43-+2I-+H2O,该反应中I2为氧化剂,AsO43-为氧化产物,所以氧化性I2>AsO43-,故D正确。
考点:考查原电池原理及化学平衡的移动。


科目:高中化学 来源: 题型:单选题
N2+3H2一定条件2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在盛有足量M的体积可变的密容器中加入N,发生反应:M(s)+2N(g) 4P (g)+Q(g)
4P (g)+Q(g)
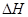 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是: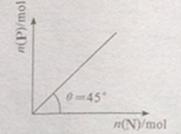
| A.平衡时N的转化率为50% |
B.当温度升高后,则图中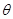 >45 >45 |
| C.若再加入N,则正、逆反应速率均逐渐增大 |
| D.若再加入N,则反应体系中气体密度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是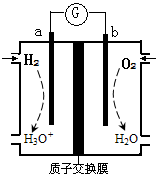
| A.加入铜粉,v(H2) 增大 |
| B.加入NaCl固体,会增大Cl—浓度,从而使v(H2)增大 |
| C.加入NaHSO4固体v(H2)不变 |
| D.加入水,锌不与水反应,v(H2)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知图①~④的相关信息,下列相应叙述正确的是 ( )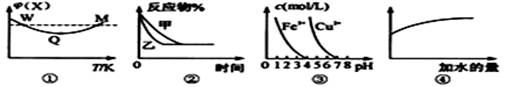
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 |
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小 3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积一定的密闭容器中,置入一定量的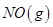 和足量
和足量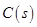 ,发生反应
,发生反应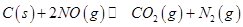 ,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是
,平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是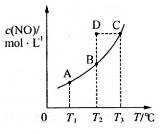
| A.该反应的△H>0 |
B.若该反应在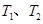 时的平衡常数分别为 时的平衡常数分别为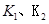 ,则 ,则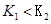 |
C.在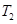 时,若反应体系处于状态D,则这时一定有 时,若反应体系处于状态D,则这时一定有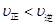 |
D.在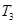 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积为2 L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
| A.该温度下此反应的平衡常数的值K=25/4 |
| B.该反应前5 min的平均速率:v(N)=0.002 mol·L-1·min-1 |
| C.在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
| D.若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):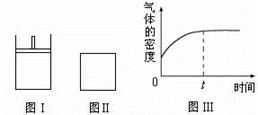
2X(?)+ Y(?) a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ> Ⅱ |
| C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y都为气态 |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4 (g) + 2N2 (g) + 6H2 (g)  Si3N4(s) + 12HCl (g) ?H < 0
Si3N4(s) + 12HCl (g) ?H < 0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | N2 的物质的量 | H2的转化率 |
| C | H2的浓度 | 平衡常数K |
| D | 压强 | N2 的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com