
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
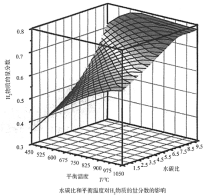
①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
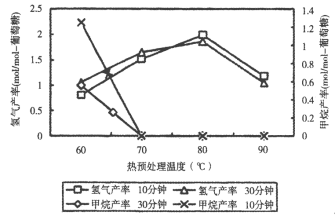
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。
【答案】+206.3 水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质量分数增大 66.7% 4.32×10-2(Mpa)2 ![]() 80℃
80℃
【解析】
(1)①+④2×②2×③即得甲烷水蒸气的重整反应方程式,用盖斯定律求甲烷水蒸气重整反应的△H;
(2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答;
②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,列三段式求解CH4的转化率、压强平衡常数;根据压强与气体物质的量成正比,结合三段式计算;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图可知。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
②CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
③H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
④CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)CO(g)+3H2(g),则甲烷水蒸气的重整反应△H=△H1+△H42△H22△H3=(890.341+2×283.0+2×285.8)kJmol1=+206.3 kJmol1;
(2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知,水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气;
②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为3mol,达化学平衡时,甲烷消耗xmol,则:
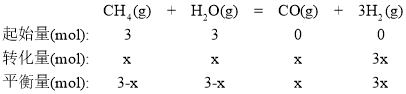
H2的物质的量分数=![]() =
=![]() =0.6,解得x=2mol,转化率α(CH4)=
=0.6,解得x=2mol,转化率α(CH4)=![]() ×100%=
×100%=![]() ×100%=66.67%,平衡常数K=
×100%=66.67%,平衡常数K=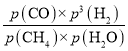 =
=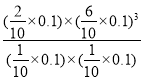 (Mpa)2=4.32×10-2(Mpa)2;反应速率v=kp(CH4)p-1(H2)=k
(Mpa)2=4.32×10-2(Mpa)2;反应速率v=kp(CH4)p-1(H2)=k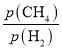 =k
=k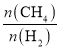 =k×
=k×![]() =
=![]() ;
;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,由图可知,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.丙烯的结构简式为 CH3CHCH2
B.结构为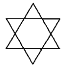 的有机物的分子式为 C12H12
的有机物的分子式为 C12H12
C.分子式为 C4H9Cl 的同分异构体共有 5 种
D.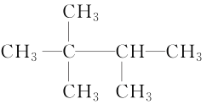 与(CH3)3CCH(CH3)2 不是同一物质
与(CH3)3CCH(CH3)2 不是同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】司替戊醇(d)用于治疗两岁及以上Dravet综合征相关癫痫发作患者,其合成路线如图所示。下列有关判断正确的是( )

A.b的一氯代物有4种
B.c的分子式为C14H14O3
C.1mold最多能与4molH2发生加成反应
D.d中所有碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 ΔH1 快速平衡
NO2+NO3 ΔH1 快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2 慢反应
第三步 NO+NO3→2NO2 ΔH3 快反应
下列说法正确的是( )
A.使用催化剂可以改变第一步中NO2平衡产量
B.第二步NO2和NO3的碰撞都是有效的
C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3
D.第二步反应的活化能小于第三步反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )

A.氢氧化钠的物质的量浓度为1 mol·L-1
B.曲线b是氢氧化钠滴定盐酸的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下所示,其中属于有机高分子的是
A.  港珠澳大桥桥墩——混凝土
港珠澳大桥桥墩——混凝土
B.  “人造太阳”核聚变实验装置——钨合金
“人造太阳”核聚变实验装置——钨合金
C.  高铁轨道与地基之间填隙减震——聚氨酯
高铁轨道与地基之间填隙减震——聚氨酯
D.  “玉兔”月球车太阳能电池帆板——硅
“玉兔”月球车太阳能电池帆板——硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。人工固氮最有效的方法是合成氦,一种工业合成氨的简易流程如图所示(净化、后期处理等流程未列出):

回答下列问题:
Ⅰ.步骤A制氢气的原理之一是CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)已知:H2、CH4的燃烧热分别为285.8kJ/mol、890.31k/mol;H2O(g)H2O(l) H=-44kJ/mol则a=____kJ/mol。
(2)在密闭容器中,既能加快反应速率,又一定能提高平衡体系中H2体积分数的措施是_____(填序号)。
a.加入催化剂 b.升高温度 c.降低压强 d.增大c(H2O)
Ⅱ.步骤B完成了原料气准备后,通过步骤C合成氨,其原理为N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol。
2NH3(g) H=-92.4kJ/mol。
(3)若T℃下,向一个容积为2L的真空密闭容器中(有催化剂)通入lmol N2、3mol H2,1分钟后达到化学平衡状态,测得容器内的压强是开始时的0.8倍。则:
①下列叙述可说明该反应已经达到化学平衡状态的是______(填序号)。
a.3v(H2)正=2v(NH3)逆 b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变 d. 1个N≡N键断裂的同时有3个H—H键生成
②t分钟内v(H2)=_______。
③T℃下该反应的K=___________(列出计算式即可)。
④一定条件下,向体积相同的甲(含催化剂)、乙两个容器中分别充入等物质的量的N2和等物质的量的H2进行合成氨反应,均反应1小时、测得N2的转化率随温度变化如图所示,a、b、c三点中达到化学平衡状态的点有_________,乙装置中N2转化率随着温度的升高先升后降的原因可能是______。

(4)我国科学家成功研制出一种高效电催化固氮催化剂Mo2N,其固氮原理如图所示,该装置中,阴极上的电极反应式为______。
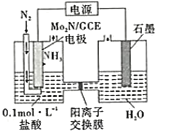
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com