
【题目】对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 ΔH1 快速平衡
NO2+NO3 ΔH1 快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2 慢反应
第三步 NO+NO3→2NO2 ΔH3 快反应
下列说法正确的是( )
A.使用催化剂可以改变第一步中NO2平衡产量
B.第二步NO2和NO3的碰撞都是有效的
C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3
D.第二步反应的活化能小于第三步反应的活化能
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成 AsCl3,AsCl3用 LiAlH4还原生成 AlH3。下列说法正确的是( )
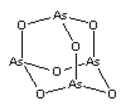
A.As2O3 分子中 As 原子的杂化方式为 sp
B.LiAlH4为共价化合物
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于 109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NH3 是极性分子,分子中 N 原子处在 3 个 H 原子所组成的三角形的中心
B.氨气易溶于水的原因之一是氨气分子与水分子之间能形成氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱的排列顺序为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.12g石墨中含有σ键的物质的量为1.5mol
B.硫离子电子共有18种运动状态,且其2p与3p轨道形状和能量相等
C.电负性:C<N<O
D.I3+离子的几何构型是V型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是( )

A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.在加热条件下,反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
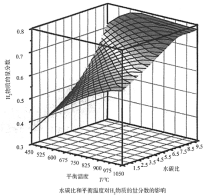
①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。
(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
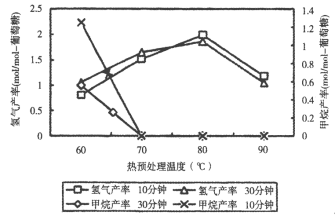
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
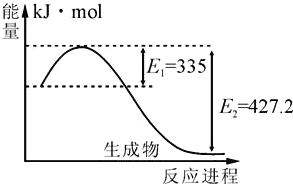
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1980年,古迪的夫发明了钴酸锂材料,这种材料的结构可以使锂离子在其中快速移动。以LiCoO2作电极材料的锂离子电池在充、放电时的微观粒子变化如图所示,下列说法正确的是
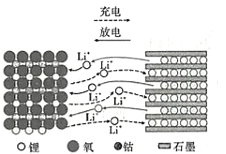
A.LiCoO2是电池的负极材料
B.充电时,LiCoO2电板的电势低于石墨电极
C.充电时,阳极发生的反应是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放电时,当1mol电子转移,则石墨电极质量减少7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com