
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是( )

A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.在加热条件下,反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢、碳、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式___。
(2)实验室用KSCN溶液、检验Fe3+。C、N、O的电负性由大到小的顺序为___(用元素符号表示),一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式___。
(3)FeCl3的熔点为306℃,沸点为315℃FeCl3的晶体类型是__。FeSO4常作补铁剂,SO42-的立体构型是__。
(4)CH3OH分子中O原子的杂化方式为___,键角:H-C-H___H-O-C。(填“<”、“>”、“=”)CH3OH能与H2O以任意比互溶的原因是___。
(5)已知C60分子结构和C60晶胞示意图(如图I、图Ⅱ所示):
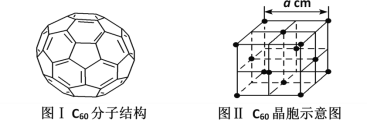
则一个C60分子中含有σ键的个数为__,与每个C60分子距离最近且相等的C60分子有__个,C60晶体的密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 ΔH1 快速平衡
NO2+NO3 ΔH1 快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2 慢反应
第三步 NO+NO3→2NO2 ΔH3 快反应
下列说法正确的是( )
A.使用催化剂可以改变第一步中NO2平衡产量
B.第二步NO2和NO3的碰撞都是有效的
C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3
D.第二步反应的活化能小于第三步反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄的结构如图所示,下列说法错误的是
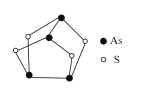
A.雄黄中硫的价态为-2价
B.古代熏蒸的消毒原理与H2O2、酒精相同
C.佩戴药剂香囊是中医独特的防疫措施
D.生活中也可使用火、盐水消毒器具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
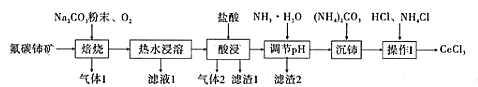
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com