
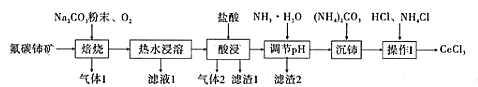
����Ŀ���й���ϡ����Դʮ�ַḻ���п��ɼ�ֵ�Ĵ����������һ��ijʵ��С�������ú������衢�������ʵķ�̼����(��Ҫ�ɷ�ΪCeFCO3)�Ʊ����Ȼ��棬�����ͼ��ʾ���̣�
��֪����Ce2O3�ڼ����������ܱ���������������������ˮ������ǿ�����Ե�CeO2��
��M(CeCl3)=246.5g/mol����ˮ��Һ��Ce4+�ܱ���ԭ��Ce3+��
��0.1mol��L-1�����������γ��������������pH���£�
���������� | Fe3+ | Ce3+ | Al3+ |
��ʼ������pH | 1.5 | 7.6 | 3.4 |
������ȫ��pH | 2.8 | 9.4 | 4.7 |
�ش��������⣺
(1)��̼�������Ļ��ϼ�Ϊ______������1�Ļ�ѧʽΪ__________��
(2)���շ�̼�������CeO3�Ļ�ѧ����ʽ��____________��
(3)���ʱ��������2�����ӷ�Ӧ����ʽ��_______��
(4)Ϊ��������������2��ȥ����NH3��H2O�����������Һ��pH����ܳ���______��
(5)������õ���Ce2(CO3)3��nH2Oϴ�Ӹɾ���������в���I���������֤��Ce2(CO3)3��nH2O�Ѿ�ϴ�Ӹɾ�________��
(6)����I�ǽ��õ���Ce2(CO3)3��nH2O��������������ȫ�ܽ⣬�Ⱦ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�CeCl3��7H2O���ٽ��þ�����NH4Cl��������������ȣ��õ���ˮCeCl3�����У�NH4Cl��������___________��
(7)��Ʒ���Ȳⶨ��ȷ��ȡCeCl3��Ʒ0.3750g����ƿ�У�������ʵ���������Ce3+ǡ����ȫ����ΪCe4+������0.1000mol/L��(NH4)2Fe(SO4)2 ����Һ�ζ����յ㣬�ظ�3��ʵ�飬��Һ����������ֱ�Ϊ12.48mL��12.50mL��12.52mL�������Ʒ����������Ϊ_______(����1λС��)��
���𰸡�+3 H2SiO3 4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2 2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O 7.6 ȡ�������һ��ϴ��Һ���Թ��У�����ϡHNO3��AgNO�����ް�ɫ��������������ϴ�Ӹɾ� NH4Cl���ȷֽ�����HCl������Ce3+��ˮ�� 82.2%
4NaF+4CeO2+6CO2 2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O 7.6 ȡ�������һ��ϴ��Һ���Թ��У�����ϡHNO3��AgNO�����ް�ɫ��������������ϴ�Ӹɾ� NH4Cl���ȷֽ�����HCl������Ce3+��ˮ�� 82.2%
��������
(1)���ݻ��ϼ۴�����Ϊ����з�����(2)�����̼������Ϣ������(3)���MnO2��Ũ����ķ�Ӧ���⣻(5)ɸѡ��Һ�д��������������Cl-֤����(6)����ˮ�ⷴӦԭ�����(7)ȡIƽ��ֵ12.50mL���м��㡣
(1)�ɷ�̼�������Ҫ�ɷ�ΪCeFCO3�����ݻ��ϼ۴�����Ϊ�㣬FΪ-1�ۣ�CO32-Ϊ-2�ۣ����Է�̼�������Ļ��ϼ�Ϊ+3����Ϊ����̼������Ҫ�ɷ�ΪCeFCO3���������������衢���ȣ����ݿ�ͼ��֪�������������������ᣬ��������������γ�������ˮ��H2SiO3,��������1Ϊ���ᣬ�仯ѧʽΪH2SiO3���ʴ𰸣�+3��H2SiO3��
(2)���շ�̼��CeFCO3���Na2CO3��O2��Ӧ����CeO3��NaF��CO2���仯ѧ����ʽ��4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2���ʴ𰸣�4CeFCO3+2Na2CO3+O2
4NaF+4CeO2+6CO2���ʴ𰸣�4CeFCO3+2Na2CO3+O2![]() 4NaF+4CeO2+6CO2��
4NaF+4CeO2+6CO2��
(3)CeO2�����������¾���ǿ�����ԣ���������Cl-Ϊ�������䷴Ӧ�����ӷ���ʽΪ2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O���ʴ𰸣�2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O��
(4)��ΪpH=2.8ʱ����������������ȫ��pH=4.7ʱ��������������ȫ��pH=7.6ʱCe(OH)3��ʼ����������Ϊ��������������2��ȥ����NH3��H2O�����������Һ��pH����ܳ���7.6���ʴ𰸣�7.6��
(5)��Ϊ����I������������Ȼ�泥�����Ҫ�ж�Ce2(CO3)3��nH2O�Ƿ��Ѿ�ϴ�Ӹɾ��ķ�����ȡ�������һ��ϴ��Һ���Թ��У�����ϡHNO3��AgNO�����ް�ɫ��������������ϴ�Ӹɾ����ʴ𰸣�ȡ�������һ��ϴ��Һ���Թ��У�����ϡHNO3��AgNO�����ް�ɫ��������������ϴ�Ӹɾ���
(6)NH4Cl���ȶ������Ȼ�ֽ������Ȼ��⣬Ce3+��ˮ������Ce(OH)3�����Լ�NH4Cl�����������ȷֽ�����HCl������Ce3+��ˮ�⣬�ʴ𰸣�NH4Cl���ȷֽ�����HCl������Ce3+��ˮ�⣻
(7)��Һ����������ֱ�Ϊ12.48mL��12.50mL��12.52mL��ƽ��ֵΪ12.50mL������Ce4++ Fe2+= Ce3++ Fe3+������n(Ce4+)=n( Fe2+)=12.50![]() 10-3 L
10-3 L![]() =1.250
=1.250![]() 10-3mol�����Ը���Ʒ����������=
10-3mol�����Ը���Ʒ����������=![]() 100%=82.2%��
100%=82.2%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ����Ǻ���һ������ʯ�ͻ�����չˮƽ����Ҫ��־֮һ������ϩΪԭ�ϺϳɵIJ��ֲ�Ʒ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��

A.������Ӧ�Т٢ݢޣ��ӳɷ�Ӧ�Тڢ�
B.����ϩ������ϩ����ʹ����KMnO4��Һ��ɫ
C.�ڼ��������£���Ӧ������Ϊ����ש��ɫ����
D.�����Ҵ���ȡBr2��CCl4��Һ�е�Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ����֤SO2�Ļ�ԭ�Բ��ⶨ����SO2����������װ����ͼװ�á��ش��������⣺
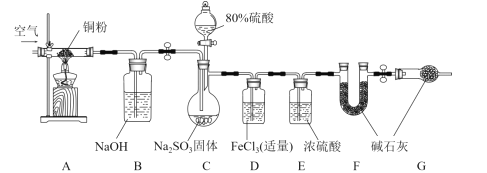
��1��C�з�����Ӧ�Ļ�ѧ����ʽ��________��Bװ�õ�������_________�����ڸ���װ��˵����ȷ����_________�����ţ���
a ��װ����������ҩƷ���������� b ʵ�鿪ʼ�����ʱ����Ҫͨ�����
c ����A��Bװ����Ϊ�˼�Сʵ����� d F��G�еļ�ʯ�ҿ��Ի�Ϊ��ˮCaCl2
��2����ͬѧ��Ϊ�ܿ���Կ���Dװ�õ���������������_________�������ӷ���ʽ��ʾ������ͬѧ��ʵ��ʱ���ֺͼ�ͬѧԤ�������һ�����ȳ����غ�ɫ������һ��ʱ����Ϊdz��ɫ�����Dz������Ϸ��ַ�Ӧ��Ϊ������
��һ����![]() ���췴Ӧ��
���췴Ӧ��
�ڶ�����![]() ������Ӧ��
������Ӧ��
�����Ҫ��֤��һ����Ӧ�ǿ췴Ӧ������������Dװ���еμ�����_________�Լ�����Ӧ��ʵ��������________��
��3��ѧϰС��ͨ��ʵ���D��Fװ���е�����������SO2��������D�м���������BaCl2��Һ��ַ�Ӧ������________��������ó���Ϊm1g��F��������Ϊm2g��C�в���SO2���������״���£�Ϊ_________L����ʵ�������У���Ȼ����ϵͳ���Ŀ���ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ʯ����Ҫ�ɷ�ΪBaCO3(��Ca2+��Mg2+��Fe3+������)��ʵ�������øÿ�ʯ�Ʊ�BaCl22H2O��������ͼ����������������Ҫ�ɷָ�����ͬ��
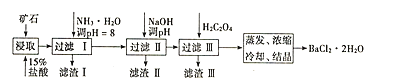
���Ϊ����ʱ������ת��Ϊ�����������ʱ��pH��
Fe3+ | Mg2+ | Ca2+ | |
��ʼ����ʱ��pH | 1.9 | 9.1 | 11.9 |
��ȫ����ʱ��pH | 3.2 | 11.1 | 13.9 |
(1)��15%�����ȡǰ������ĥ��Ŀ����______��
(2)���������Ҫ�ɷ�Ϊ______������NaOH��pH�ķ�ΧΪ______������H2C2O4ʱӦ���������ԭ����______��[��֪�������ʣ�Ksp(BaC2O4)=1.6��10-7��Ksp(CaC2O4)=2.3��10-9]
(3)��֪��25��ʱ��Ksp(BaCO3)=5.4��10-9��Ksp(CaCO3)=2.7��10-9����CaCO3�������Һ�м����Ũ�ȵ�BaCl2��Һ����BaCO3�������ɣ���д���÷�Ӧ�����ӷ���ʽ______���÷�Ӧ��ƽ�ⳣ��K=______��
(4)ȡ�Ƶõ�BaCl22H2O(����������)2.5g���100mL��Һ��ȡ10.00mL����Һ���ձ��У���������(NH4)2C2O4��Һ�����ˣ�ϴ�ӣ����õ���BaC2O4�����ù���ϡ������Һ�ܽ⣬���˳�ȥBaSO4�����������õ�H2C2O4��Һ������ƿ����0.05mol/L������ر�Һ�ζ����յ㡣
��֪��Ba2++C2O42-�TBaC2O4��
BaC2O4+2H++SO42-�TBaSO4��+H2C2O4
5H2C2O4+2MnO4-+16H+�T10CO2��+2Mn2++8H2O
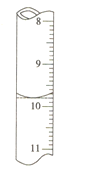
�ٵζ���ʢ�Ÿ�����ر�Һ������Ϊ______���������һ�θ��������Һ����ƿ����Һ��ɫ______����˵���ﵽ�ζ��յ㡣
�����ζ�ǰ�ζ��ܵĶ���Ϊ1.80mL���ζ��յ�ʱ�ζ�����Һ����ͼ�������BaCl22H2O�Ĵ���Ϊ______(����3λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Cu+����γ���ͼ��ʾ�����ӣ�������˵���������(����)
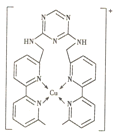
A.Cu+�ĺ�������Ų�ʽΪ[Ar]3d9
B.�������к��м��Լ����Ǽ��Լ�����λ��
C.��������̼ԭ�ӵ��ӻ���ʽ��sp2��sp3����
D.��������������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1980�꣬�ŵϵķ���������﮲��ϣ����ֲ��ϵĽṹ����ʹ����������п����ƶ�����LiCoO2���缫���ϵ�����ӵ���ڳ䡢�ŵ�ʱ�������ӱ仯��ͼ��ʾ������˵����ȷ����
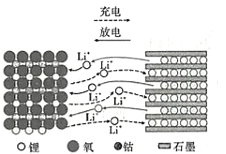
A.LiCoO2�ǵ�صĸ�������
B.���ʱ��LiCoO2���ĵ��Ƶ���ʯī�缫
C.���ʱ�����������ķ�Ӧ��LiCoO2+xe-=Li1-xCoO2+xLi+
D.�ŵ�ʱ����1mol����ת�ƣ���ʯī�缫��������7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ï��[Fe(C5H5)2]���������ȼ�����Ӽ������͵Ŀ����������컯����Ҳ�������������ռ������ɻ����ϩ(![]() )��FeCl2�����Ұ�[(C2H5)3N]�����·�Ӧ�Ƶá�
)��FeCl2�����Ұ�[(C2H5)3N]�����·�Ӧ�Ƶá�
(1)��Ԫ�����ڱ��У���Fe��ͬ������ͬ���Ҽ۲��������Ϊ10��Ԫ����_____(��Ԫ�ط���)����Ԫ����̬ԭ�Ӻ���N����ӵ�����״̬_______(���ͬ�����෴��)��
(2)���Ұ��е縺����С��Ԫ����________(��Ԫ�ط���)��CԪ�ص�_______�ӻ������HԪ�ص�________����γ�_______����
(3)����״̬��Cl�У����������һ��������������������______(�����)��
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)��֪�������еĴ��������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɵĴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɴ�������ԭ������n���������γɵĴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ![]() )�������ϩ������(
)�������ϩ������(![]() )�еĴ�����Ӧ��ʾΪ________��
)�еĴ�����Ӧ��ʾΪ________��
(5)��ï���������ҿ������л��ܼ��У��侧������Ϊ________����ï���ľ����ṹ��ͼ��ʾ(δ������)���ܶ�Ϊpg��cm-3����һ��������Fe(C5H5)2����Ŀ�ļ������ʽΪ______(�谢���ӵ�������ֵΪNA)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ӵĽṹ��ͼ��ʾ��-R Ϊ������������ A��B��D ����Ԫ��λ��Ԫ�����ڱ���ͬһ����������ڵ����ڣ�A �ķǽ����Դ��� B��D �� G �γɵ� DG3 �ڹ�ҵ�Ͽ�����Ư��ɱ��������A �� G �γɵ� AG3 ����ȫˮ�⣬��ˮ��IJ���֮һ H3AO3 ���������ϼ��ƽ����Ļ�ԭ����
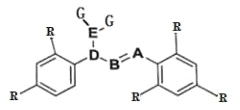
(1)����δ�ɶԵ��ӵ�ԭ�ӻ���Ӿ��д��ԡ�D ��ij�������� D2O4 �Ĵ��Դ�С���¶ȳ�����ع�ϵ�����������¶ȵ����������� D2O4 ![]() 2DO2����H______0��������������������=������
2DO2����H______0��������������������=������
(2)DG3 ����ɱ�������� HGO ��ȣ�DG3 �ɴ���ӳ�ɱ��������ʱ�䣬�Դӷ�Ӧ�������ۺ�ƽ���ƶ�����������ѡ��һ����������ԭ��____________________________��
(3)���������еķ��ǻ��ⲻ�ܷ������롣H3AO3 ������ A ԭ�������ĵ��Ӷ������˹��ۼ����γɣ����÷���ʽ��ʾ H3AO3 ��������Һ�ʼ��Ե�ԭ��_____��
(4)Һ���������2NH3(1) ![]() NH4++NH2-�ɵ��磬Һ̬ D2O4 ��Ҳ���� D2O4
NH4++NH2-�ɵ��磬Һ̬ D2O4 ��Ҳ���� D2O4![]() DO++DO3-�������������̵ı�������Ϊ___________��
DO++DO3-�������������̵ı�������Ϊ___________��
(5)T��ʱ����һ���Ϊ VL ���ܱ������з���һ������ ACl5 ���壬����ʽ������Ӧ��ACl5��s��![]() ACl3��g��+Cl2��g������H>0����������������ѹǿ�仯���±���
ACl3��g��+Cl2��g������H>0����������������ѹǿ�仯���±���
ʱ�� t/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 | �� |
��ѹ P/kPa | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 5.0 | 5.0 |
���������£��Է�ѹ��ʾ��ƽ�ⳣ�� Kp=_____(kPa)2��������������λС������ �������¶Ȳ��䣬30s ʱ��������ѹ������ƽ��������ڵ���ѹ��_____�����������������������������������������������ɾ�����������ѹ�������ڵ���ѹ��_____������������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ĺ�����������(H3PO4)��������(H3PO3)��������(H3PO2)�ȶ��֣������ڹ�ҵ�϶�����Ҫ�Ļ���ԭ�ϡ�
(1)�����ᣨH3PO3)��һ�ֶ�Ԫ���ᣬд��H3PO3�����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_______��ij�¶��£�0.01 mol L-1 H3PO3��Һ��pHΪ2.7�����¶��£�H3PO3 ��һ�����볣�� Kal=_______�� (��֪��lg2 = 0.3��lg3 = 0.5��lg5 = 0.7��H3PO3 �ĵڶ���������Բ��ƣ�
(2)ijʵ��С����NaOH��Һ������H3PO3��ˮ������Һ��c (Na+) =c(H2PO3��) + 2c(HPO32-)ʱ����Һ��______��(��������������������������
(3)��֪�������£����ᣨH3PO4)�� Kal=7.ll��10-3��Ka2 = 6.23��10-8��Ka3 = 4.5 ��10-13�� �����£�Na2HPO4��Һ��H2PO4����HPO42-��PO43-��Ũ���ɴ�С��˳��Ϊ________��
(4)��ijŨ�ȵ�������Һ�еμ�NaOH��Һ����pH����Һ��H3PO4��H2PO4����HPO42-��PO43-�����ʵ�������Ϊ�� (ƽ��ʱij���ֵ�Ũ������������Ũ��֮�͵ı�ֵ���Ĺ�ϵ��ͼ��ʾ���Է�̪Ϊָʾ��������Һ����ɫ��Ϊdz��ɫʱ��������Ҫ��Ӧ�����ӷ���ʽ��_________��
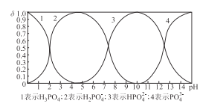
(5)��֪�������£�Ksp(FePO4) = l.3��10-22��Ksp(A1PO4) = 5.2 ��10-19�������£���Fe3+��A13+�Ļ����Һ�еμ�Na3PO4��Һ����FePO4��AlPO4ͬʱ����ʱ����Һ��c(Fe3+)��c(Al3+ ) =_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com