
【题目】已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2,I2,Fe3+,Br2四种氧化剂的氧化能力由强到弱的顺序是_________________________________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
【答案】 Cl-、Br- 0.10 mol 0.25 mol n(Fe3+)=0.50 mol/L Cl2>Br2>Fe3+>I2 I2+5Cl2+6H2O===2IO![]() +10Cl-+12H+ 0.8
+10Cl-+12H+ 0.8
【解析】试题分析:(1)根据还原剂的还原性顺序可知,发生的反应依次为2I-+Cl2=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=Br2+2Cl-,若氯水中有0.15 mol Cl2被还原,则被氧化的是0.2mol碘离子和0.1mol亚铁离子,因此所得溶液中含有的阴离子主要是Br-、Cl-,剩余Fe2+的物质的量为0.2mol—0.1mol=0.1mol。
(2)若原溶液中Br-有一半被氧化,则溶液中的碘离子和亚铁离子已全部被氧化,则根据电子得失守恒可知共消耗Cl2的物质的量为![]() ;若最终所得溶液为400mL,其中铁离子的物质的量浓度为0.2mol÷0.4L=0.5mol/L。
;若最终所得溶液为400mL,其中铁离子的物质的量浓度为0.2mol÷0.4L=0.5mol/L。
(3)根据在氧化还原反应中氧化剂的氧化性强于氧化产物可知Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是Cl2>Br2>Fe3+>I2。
(4)I2全部被Cl2氧化成HIO3(强酸),则此反应的离子方程式为I2+5Cl2+6H2O=12H++10Cl-+2IO3-。上述所有反应共消耗Cl2的物质的量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列电离方程式中书写正确的是( )
A. NaHSO4![]() Na++H++SO42﹣ B. NaHCO3
Na++H++SO42﹣ B. NaHCO3![]() Na++H++CO32﹣
Na++H++CO32﹣
C. HClO=H++ClO﹣ D. MgCl2═Mg2++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )

A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气反应生成NO2
C.CO2与NO反应生成NO2
D.NO与H2O反应生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
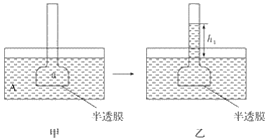
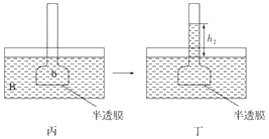
A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是

A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
C. ③一定是核酸或是组成核酸的单体核苷酸
D. 若④是参与构成植物细胞壁的一种多糖,则④最可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。 工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是

A. 阳极电极反应式:Fe-6e- +8OH-=FeO42- +4H2O
B. 甲溶液可循环利用
C. 离子交换膜a是阴离子交换膜
D. 当电路中通过2mol电子的电量时,会有1molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
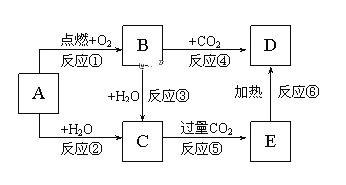
填写下列空白:
(1)写出化学式:A______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)反应③的化学方程式中:氧化剂是________还原剂是_________
(4)写出反应②的化学方程式:并用双线桥法标出电子转移方向和数目________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com