
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是

A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内H2的平均反应速率为0.1 mol·L-1·min-1,则经过时间为( )
A. 2 minB. 3 minC. 4 minD. 5 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
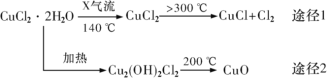
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应2A(g) + B(g)![]() 3C(g),各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。
3C(g),各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图1中t0~t1阶段c(B)未画出。
图1 图2
图2
(1)若t1=15 min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4~t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
K1 | K2 | K3 | K4 | K5 |
则K1=____________(计算式),K1、K2、K3、K4、K5之间的关系为____________(用“>”“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:2A(g) + B(g)![]() 3C(g) ΔH,用含有a的代数式表达 ΔH = _________。
3C(g) ΔH,用含有a的代数式表达 ΔH = _________。
(4)在相同条件下,若起始时容器中加入4mol A、2 mol B和1.2 mol C,达到平衡时,体系中 C的百分含量比t1时刻C的百分含量________(填“大于”“小于”“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是
A.NaOH溶液,W1=W2B.无水乙醇,W1=W2
C.NaHSO4溶液,W1<W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:

(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为__________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇为原料制备
(丙酮)、乙醇为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,能说明反应A(s)+ 2B(g)![]() C(g)+ D(g)一定处于化学平衡状态的是
C(g)+ D(g)一定处于化学平衡状态的是
A. 混合气体的密度不再改变 B. 容器内的压强保持不变
C. C与D的物质的量相等 D. 消耗1 mol B的同时生成 0.5 mol D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com