
| m |
| M |
 ,
, ;
;| 11.5g |
| 23g/mol |
| 2mol |
| 0.5mol |
| 22.4L |
| V |
| 11.5g |
| 23g/mol |
| 100 |
| 1 |
| x-0.5 |
| 0.5 |


科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98g |
| B、2mol水的质量是18g/mol |
| C、氯化氢的摩尔质量等于它的相对分子质量 |
| D、22g二氧化碳的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
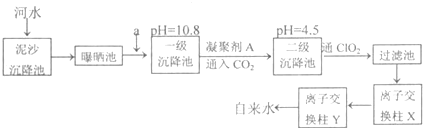
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
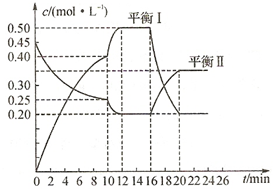 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
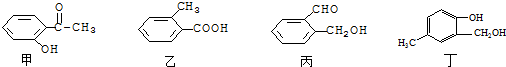
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5L 0.1mol/L的NaCl溶液 |
| B、100mL 0.2mol/L的MgCl2溶液 |
| C、50mL 0.2mol/L的AlCl3溶液 |
| D、1L 0.5mol/L盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com