
【题目】A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)E在周期表中的位置为 。
(2)下列说法正确的有 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 。
(5)A与B可形成一种二元化合物X,其中A元素质量分数为2.33%.据研究X显弱酸性。回答:
①X的电离方程式为 __。
②X电离的阴离子结构与二氧化碳相似,则其电子式为 。
【答案】(1)第三周期第ⅤA族
(2)①②③
(3)3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
(4)2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-
(5)①HN3![]() H++N3-②
H++N3-②![]()
【解析】试题分析:A、B、C、D、E、F为短周期元素,且原子序数依次增大,A是原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则为B为N元素,甲为NH4NO3;E与B同主族,则E为P元素;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,则D为Si、乙为SiH4;C的阳离子与F的阴离子相差一个电子层,结合原子序数可知,C、F均处于第三周期,F原子序数大于P,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,故F为S、C为Na、丙为Na2S。
(1)E为P元素,在周期表中的位置为:第三周期第VA族,故答案为:第三周期第VA族;
(2)①化合物乙为SiH4,分子中只含有极性共价键,故①正确;②同周期自左而右原子半径减小,故原子半径C(Na)>D(Si)>E(P)>F(S),故②正确,③非金属性B(N)>E(P),故氢化物中B的更稳定,故③正确;④化合物为NH4NO3,含有离子键、共价键,化合物丙为Na2S,只含有离子键,故④错误;故选:①②③;
(3)将F燃烧的产物为SO2,通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+,故答案为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+;
(4)由以上元素构成的10电子分子与18电子分子反应生成盐,是氨气与硫化氢反应,反应的离子方程式为2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-,故答案为:2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-;
(5)H与N可形成一种二元化合物X,其中H元素质量分数为2.33%,X显弱酸性,X为HN3。
①HN3的电离方程式为HN3![]() H++N3-,故答案为:HN3
H++N3-,故答案为:HN3![]() H++N3-;
H++N3-;
②阴离子N3-与二氧化碳相似,则其电子式为![]() ,故答案为:
,故答案为:![]() 。
。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
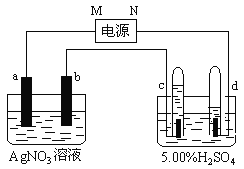
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。下同),H2SO4溶液的pH ,若要硫酸恢复成原溶液需加入
(3)Pt电极上生成的物质是 ,其质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于吸热反应的是
A. 浓H2SO4溶于水 B. 生石灰溶于水
C. 镁与稀盐酸反应 D. NH4Cl固体与Ba(OH)2·8H2O混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某200 mL氯化镁和氯化铝混合液中c(Mg2+)为0.3 mol/L,c(Cl-)为1.2 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol/L NaOH溶液的体积为
A.70 mL B.60mL C.80 mL D.128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
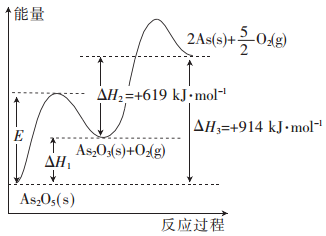
(1)As2O5分解生成As2O3和O2的反应中,加入催化剂,E__________(填“增大”、“减小”或 “不变”,下同),△H1_________。
(2)As2O3分解生成As和O2的热化学方程式为____________________。
(3)As2O3和O2反应生成As2O5的热化学方程式为_____________________。
(4)若1 mol As2O5分解生成0.4 mol As2O3和1.2 mol As,则该分解过程中,需吸收的总能量为_________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的本质区别是( )
A. 是否为大量分子和离子的集合体
B. 分散质粒子的大小
C. 能否通过滤纸或半透膜
D. 是否均一、稳定、透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定量的铁粉加入到装有200 mL某浓度的稀硝酸溶液的容器中充分反应。
①容器中剩余m1 g铁粉,收集到NO标准状况下体积为672 mL。
所得溶液中溶质的化学式 ,原硝酸溶液的物质的量浓度 mol/L。
②向上述固、液混合物中逐滴加入稀硫酸,直到不再产生NO气体为止,此时容器中还剩余铁粉m2 g
则此时溶液中溶质的化学式 ,m1-m2 的值为 g(精确到0.1g )
(2)铝电池性能优越,Al-空气燃料电池通常以NaCl溶液或KOH溶液为电解质溶液,通入空气的电极为正极,以多孔石墨为正极材料。若以NaCl溶液为电解质溶液,正极的反应式为______________;若以KOH溶液为电解质溶液,电池总反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.4 mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表:
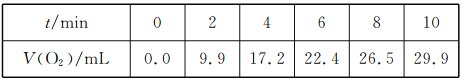
下列叙述错误的是(溶液体积变化忽略不计)( )
A.反应至6 min时,c(H2O2)=0.20mol/L
B.反应至6 min时,H2O2分解了40%
C.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol.L-1.min-l
D.6~10 min的平均反应速率:可(H2O2) <3.3×10-2 mol.L-1.min-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO ![]() CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1)原混合气体的物质的量是 ;生成沉淀的摩尔质量是 。
(2)原混合气体中甲烷的体积是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com