
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。己知:
①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A、C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn-1。请回答下列问题:
(1)下列叙述正确的是_____(填序号)。
A.金属键的强弱:D>E B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为______;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为______ (填元素符号)。
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为_____。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B 3-中心原子的杂化轨道类型为____________。
【答案】 BD 1s22s22p63s23p63d104s1 Cr 平面三角形 sp杂化
【解析】本题分析:本题主要考查原子结构与分子结构。A、B、C、D、E、F六种元素的原子序数依次递增。A、B、C、D、E均为短周期主族元素。①F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,F是铜。②A、C原子p轨道的电子数分别为2和4,A、C应为碳、氧。④E原子价电子(外围电子)排布为msnmpn-1,即为ms2mp1,E应为铝。③D原子最外层电子数为偶数,D应为镁。
(1)A.金属原子半径越小,价电子越多,金属键越强,所以金属键的强弱:D<E,故A错误;B.D的2p轨道处于全充满的较稳定状态,所以基态原子第一电离能:D>E,故B正确;C.六种元素中,电负性最大的元素是C,故C错误;D.离子的半径越小,所带电荷越多,离子晶体的晶格能越大,所以晶格能:NaCl<DCl2,故D正确。故选BD。
(2)F基态原子的核外电子排布式为1s22s22p63s23p63d104s1;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为Cr。
(3)A与C形成的非极性分子是CO2分子,该分子与过量强碱反应生成的酸根离子是![]() ,
, ![]() 的中心原子碳原子的价层电子对数是3,所以
的中心原子碳原子的价层电子对数是3,所以![]() 的空间构型为平面三角形。
的空间构型为平面三角形。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B是氮,B3-与CO2是等电子体,中心原子的杂化轨道类型与CO2的碳原子相同,为sp杂化。


科目:高中化学 来源: 题型:
【题目】关于石油和石油化工的说法错误的是( )
A. 石油的主要成分是碳氢化合物
B. 石油分馏得到的各馏分仍是混合物
C. 石油裂解气的主要成分是甲烷
D. 石油裂化的目的是为了提高轻质油的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+H2(g) △H=Q2kJ·mol-1
CO2(g)+H2(g) △H=Q2kJ·mol-1
②H2O(g)= H2O(I) △H=Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为________________。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
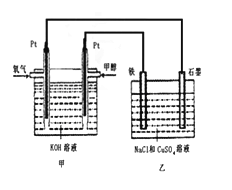
(2)写出甲中通入甲醇这一极的电极反应式_______________________。
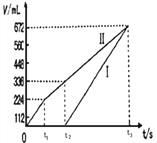
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___________,原混合溶液中NaCl的物质的量浓度为_______mol/L。(设溶液体积不变)
(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_________g。
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是____________。
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,PH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同PH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=________________。(用准确的数学表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃1mol 最多能和2molHBr 加成反应,其所得的产物又能跟8molBr2 发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
A. C4H6 B. C3H4 C. C3H6 D. C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.11.2 L的戊烷所含的分子数为0.5NA
B.28 g乙烯所含共用电子对数目为6NA
C.在标准状况,11.2 L三氯甲烷所含分子数为0.5NA
D.现有乙烯、乙炔的混合气体共14 g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 含有NA个氯原子的氯气的质量是71g
B. 标准状况下,2.24L CCl4所含分子数为0.1 NA
C. 1L 1mol/L 盐酸中所含离子总数为NA
D. 2.4g镁在足量的氧气中燃烧,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 将NaOH固体直接放在托盘天平的托盘上称量
B. 将NaOH固体加水溶解,待所得溶液冷却到室温后,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠。其中含极性键的非极性分子是( )
A.②③⑤ B.仅②③ C.仅① D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com