
| A、Na+、K+、Cl-、CO32- |
| B、Mg2+、NH4+、Cl-、NO3- |
| C、CH3COO-、SO42-、Ba2+、K+ |
| D、Fe2+、Cl-、NO3-、Ba2+ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
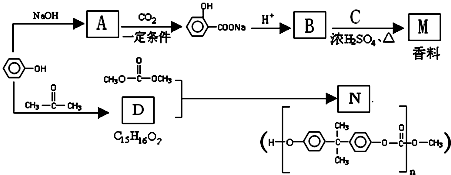
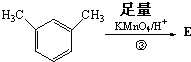 ,则E的分子式为
,则E的分子式为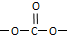 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2、Cl2、HCl、酸雨 |
| B、HCl、SO2、N2、粉尘 |
| C、NH3、CO、CO2、雾 |
| D、SO2、NO2、CO、烟尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 10 | 20 | 30 | 40 | 50 |
| N(SO3)/mol | 0.4 | 0.6 | 1.2 | 1.6 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
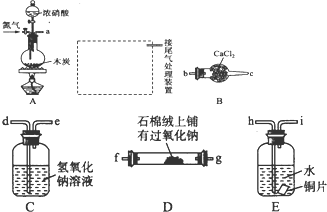
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入氯化钠溶液,c(H+)不变,n(H+)变大 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com