
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入氯化钠溶液,c(H+)不变,n(H+)变大 |
| D、将水加热,Kw增大,pH不变 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 纯水 | 加少量盐酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比较 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的电离平衡移动方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cl-、CO32- |
| B、Mg2+、NH4+、Cl-、NO3- |
| C、CH3COO-、SO42-、Ba2+、K+ |
| D、Fe2+、Cl-、NO3-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
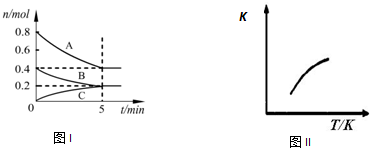
| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D、HCl的稳定性强于HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、③⑤⑥ |
| C、③⑤ | D、②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已吸潮 |
| B、摇匀后液面低于刻度线,不再补加水 |
| C、有少量NaOH溶液残留在烧杯内 |
| D、向容量瓶加水至时刻度线时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
| B、水电离的热化学方程式为:H2O(1)?H+(aq)+OH-(aq)△H=+57.3kJ/mol |
| C、当c>0.1时,一定不存在:c(Na+)=c(F-) |
| D、若混合后溶液中:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com