
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 丙烯分子有7个σ键,1个π键
B. 由2H和18O所组成的水11g,其中所含的中子数为4NA
C. 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA
D. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个
【答案】D
【解析】A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A错误;B、由2H和18O所组成的水为2H218O,根据n=![]() 可知11g水的物质的量n=
可知11g水的物质的量n=![]() =0.5mol,而1mol2H218O含12mol中子,故0.5mol水所含的中子数为6NA,选项B错误;C、硅形成四个Si-O键,0.1mol SiO2晶体中,含有“Si-O”键的数目为0.4NA,选项C错误;D、根据反应式KIO3+6HI=KI+3I2+3H2O可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以每生成3 mol I2转移的电子数为5NA,选项D正确;答案选D。
=0.5mol,而1mol2H218O含12mol中子,故0.5mol水所含的中子数为6NA,选项B错误;C、硅形成四个Si-O键,0.1mol SiO2晶体中,含有“Si-O”键的数目为0.4NA,选项C错误;D、根据反应式KIO3+6HI=KI+3I2+3H2O可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以每生成3 mol I2转移的电子数为5NA,选项D正确;答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图。下列说法一定不正确的是
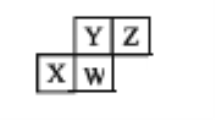
A. Z原子比X原子的最外层电子数多2个
B. 原子半径:W>X>Z>Y
C. 最高价氧化物对应的水化物的碱性:X>W
D. Y单质与氢气反应条件比Z单质更苛刻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关卤族和碱金属元素性质的递变规律说法正确的是
A.卤族元素从F到I,对应氢化物的还原性逐渐增强
B.碱金属元素与O2反应均可得到多种氧化物
C.碱金属元素从Li到Cs,熔沸点逐渐升高
D.X2+2NaI=2NaX+I2(X为:F、Cl、Br)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与 Y同族,Z 与X 形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子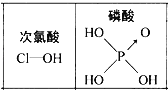
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列烃命名:
(1) ____。
____。
(2) ____。
____。
(3)![]() ____。
____。
(4)有机化合物 的名称为____或____。
的名称为____或____。
(5)2,4二甲基2己烯写出结构简式____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com