


科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
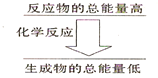 I.写出下列热化学反应方程式
I.写出下列热化学反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ml) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因碘酒使蛋白质变性,故常用于外用消毒 |
| B、麻黄碱可用于止咳平喘,就是因为它能起到消炎作用 |
| C、长期大量使用阿司匹林有不良反应,应立即停药并静脉注射Na2CO3溶液 |
| D、能用于治疗胃酸过多的抗酸药有盘尼西林 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌为负极,Ag2O为正极 |
| B、锌发生还原反应,氧化银发生氧化反应 |
| C、原电池工作时,负极附近溶液的pH值减小 |
| D、原电池工作时,电子流动方向为Zn→Ag2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com