
����Ŀ������Ӧ����㷺�Ľ���������±����������Լ������ĺ������ξ�Ϊ��Ҫ�����
��1��������أ�K2FeO4����һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽ��Fe(OH)3+ClO��+OH����FeO42��+H2O+Cl����δ��ƽ������ƽ�������ӷ���ʽ���õ����ŷ��������ת�Ʒ������Ŀ��___
___Fe(OH)3+___ClO��+___OH����___FeO42��+___H2O+___Cl��
�÷�Ӧ�У���ԭ����___������ԭ��Ԫ����___��
��2����һ���¶��£�������������һ����̼������Ӧ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)+Q��
2Fe(s)+3CO2(g)+Q��
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�������
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 64.0 | 50.7 | 42.9 |
�÷�Ӧ��ƽ�ⳣ������ʽΪ___��Q__0�����������������=������
��3�����ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣬��ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����v(CO2)=___��CO��ƽ��ת����Ϊ____��
��4�������CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��___��
A������Fe���� B������Fe2O3����
C���Ƴ�����CO2 D����߷�Ӧ�¶�
E����С�������ݻ� F��������ʵĴ���
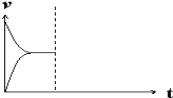
��5�����ں�ѹ�ܱ�������ͨ��1molH2��1molCO2������Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g)+41kJ������Ӧ�ﵽƽ�����������������ʱ����ͨ��1molH2��1molCO2�Ļ�����壬����ͼ�л�����(v��)����(v��)��Ӧ������ʱ��t�仯��ʾ��ͼ��___
CO2(g)+H2(g)+41kJ������Ӧ�ﵽƽ�����������������ʱ����ͨ��1molH2��1molCO2�Ļ�����壬����ͼ�л�����(v��)����(v��)��Ӧ������ʱ��t�仯��ʾ��ͼ��___
���𰸡�![]() Fe��OH��3 ��Ԫ��
Fe��OH��3 ��Ԫ�� 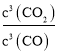 �� 0.006molL-1min-10.006molL-1min-1 60% CD
�� 0.006molL-1min-10.006molL-1min-1 60% CD 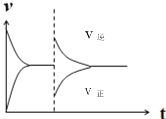
��������
��1�����ݵ����غ��Ԫ���غ���ƽ������ԭ����ʽ���õ��ӻ��ϼ۽�������������ʧ���ӻ��ϼ���������ԭ����
��2��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ������岻�ܴ���K�ı���ʽ�У�ͼ�����ݷ��������¶�����ƽ�ⳣ����С��
��3�����ݻ�ѧƽ������ʽ��ʽ���㣬��ƽ��ʱCO�����ʵ����仯Ϊnmol����������ʽ��ʾ��ƽ��ʱCO��CO2�����ʵ������������ʵ�������Ũ�ȴ���ƽ�ⳣ������n��ֵ����������CO��Ũ�ȱ仯����������ת���ʡ�
��4�����CO��ƽ��ת���ʣ�Ӧʹƽ��������Ӧ�ƶ�������������CO�����������ѡ�����ƽ���ƶ�ԭ��������
��5���÷�Ӧ�������������ķ�Ӧ��ѹǿ��Ӱ��ƽ�⣻���Ǻ�ѹ�����¼�����ͨ��1mol H2��1mol CO2�Ļ��������������ݻ����������Ũ��������Ӧ��Ũ�ȼ�С����Ӧ���ʻᷢ���仯���ݴ˷�����
��1����Ԫ�ػ��ϼ�+3�۱仯Ϊ+6�ۣ���Ԫ�ػ��ϼ�+1�۱仯-1�ۣ�����ת������6e-����Ӧ�����ӷ���ʽΪ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O������Ӧ�л�ԭ��Fe��OH��3��������ΪClO-������ԭ��Ԫ������Ԫ�أ��ʴ�Ϊ��![]() ��Fe��OH��3����Ԫ�أ�
��Fe��OH��3����Ԫ�أ�
��2��I��![]() �� K=
�� K=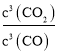 ���ɱ������ݿ�֪���¶�Խ�ߣ�KԽС���������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����Q>0��
���ɱ������ݿ�֪���¶�Խ�ߣ�KԽС���������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����Q>0��
�ʴ�Ϊ��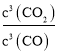 ��>��
��>��
��3����һ���ݻ�Ϊ10L���ܱ������У�1 000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ũ����Q��K=64����Ӧ������У���Ӧ����10min��ﵽƽ�⣬��ƽ��ʱCO�����ʵ����仯Ϊnmol����
������ �����n=0.6mol������v(CO2)=
�����n=0.6mol������v(CO2)=![]() ��CO��ƽ��ת����Ϊ
��CO��ƽ��ת����Ϊ![]() ���ʴ�Ϊ��0.006molL-1min-1��60%��
���ʴ�Ϊ��0.006molL-1min-1��60%��
��4��A�����ǹ��壬����Fe��������Ӱ��ƽ���ƶ���CO��ƽ��ת���ʲ��䣬��A����
B���������ǹ��壬����Fe2O3��������Ӱ��ƽ���ƶ���CO��ƽ��ת���ʲ��䣬��B����
C���Ƴ�����CO2��ƽ��������Ӧ�ƶ���CO��ƽ��ת��������C��ȷ��
D���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�����ͷ�Ӧ�¶ȣ�ƽ��������Ӧ�ƶ���CO��ƽ��ת��������D��ȷ��
E����Ӧǰ����������ʵ������䣬��С�������ݻ�������ѹǿƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��E����
F��������ʵĴ�����ƽ�ⲻ�ƶ�����F����
��ѡCD��
��5�����ڸ÷�Ӧ�����������ȵķ�Ӧ��ѹǿ��Ӱ��ƽ�⣬�Һ�ѹ���������յõ�ƽ��ʱ�ĸ���ֺ�����Ũ����ԭƽ����ȫ��ͬ�����Դﵽƽ��ʱ�ķ�Ӧ������ԭƽ��ʱ��������ȣ�����ͨ��1mol H2��1mol CO2�Ļ����������ں�ѹ�����£��������ݻ�����������Ũ������Ӧ��Ũ�ȼ�С�������淴Ӧ������������Ӧ���ʼ�С��֮���淴Ӧ������С������Ӧ�����������յõ���ԭƽ����ȵ����ʣ��ݴ˻���������v�������棨v������Ӧ������ʱ��t�仯��ʾ��ͼΪ��
 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������������װһ��ʯ�ͷ����װ�ã����������ʵ�飬���Եõ����ͺ�ú�͡�

(1)д���������������ƣ�
��________����________����________��
(2)�����������������ҵ�˳������ĸa��b��c�����������ӣ�e����____������____������____������____������____������____������____������____������____����
(3)��������A��________(������ˮ����������ˮ��������ͬ)��B��________��
(4)����ʱ���¶ȼ�ˮ����Ӧ��________(λ��)��
(5)�ڢ���ע��ԭ�ͺӼ�Ƭ���Ƭ��Ŀ����_______
(6)��ʵ�������Ϊ��̽��ʯ�����Ƿ���ϩ����ijѧ���â��е���������һ��̽��ʵ�飬���������������________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̿����Ҫ�ɷ���MnO2��������������������þ������п��ͭ�Ļ���������ʡ����������Ҫ�ɷ���FeS2�������й衢��������������ʡ���ҵ�������̿��Ʊ�̼���̲���������泥�����Ҫ�������£�
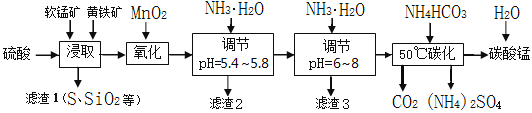
��֪�������Ӵӿ�ʼ�γ��������������������ʱ��Һ��pH���±���
�������� | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
��ʼ����pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
��ȫ����pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
��1����߽����ʵĿɲ�ȡ�Ĵ�ʩ��_________��
A���ʵ������¶� B������ C������������ D����ѹ
��2����ȡ��ɺ�ȡ��ȡҺ����������KSCN��Һ�������������ȡʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��____________________________________________��
��3������pHΪ5.4��5.8��Ŀ����_____________________________________________��
��4������3����Ҫ�ɷֵĻ�ѧʽ��_____________��
��5��50��̼�����̷�����Ӧ�����ӷ���ʽ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������0.1 mol/L��NaOH��Һ450 ml������˵����ȷ����( )
A.��������ƽ�������������Ϊ1.8 g
B.����NaOH����ʱ�����ձ��н���
C.����ʱ���Ӷ���������Һ��Ũ��ƫ��
D.��Һ���ڿ̶�����2-3 mmʱ�����ý�ͷ�ιܵμ�����ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪a��b��c��d���ֶ���������Ԫ�أ������ڱ������λ����ͼ������˵����ȷ����
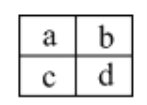
A. a��c��Ԫ�ص��������һ�����
B. ԭ�Ӱ뾶��С˳��Ϊ��c>d>b>a
C. a��b��Ԫ�ؿ����γɶ��ֹ��ۻ�����
D. c��d����Ԫ����̬�⻯����ȶ��ԱȽϣ�c > d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5�л�������ױ����л����������Ļ���ԭ��֮һ�������Ҵ��ͼױ�Ϊԭ�ϣ��ɰ�����·�ߺϳɷ���ʽ��ΪC9H10O2���л�������ƷE��J��

��֪��
��ش�
(1)д�����з�Ӧ����ʽ
��B+D��E______________________________________��
��G��H________________________________________��
(2)�ٵķ�Ӧ����Ϊ__________���ڵķ�Ӧ����Ϊ__________��F�Ľṹ��ʽΪ__________��
(3)E��J�ж���ͬ���칹�壬д����������������4��ͬ���칹��Ľṹ��ʽ��Ҫ����E��J��ͬ�����ʢڱ�����������ȡ�����ұ����ϵ�һ�ȴ���ֻ�����֡�
__________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ŷ����Ƴ���TM��LiH��TM��ʾ���ɽ�������˫������ϵ��������������º������µ����������ϳ�NH3��Ч�ʣ�ԭ��ʾ�����£�

���з������������ǣ�������
A.״̬��������������N��N����������B.�ϳ�NH3�ܷ�Ӧ��ԭ����������100%
C.��TM��LiH���ܽ��ͺϳɰ���Ӧ�ġ�HD.����NH3��2LiNH+3H2�T2LiH+2NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͷ�к���ClԪ�ص�֤������ͬѧ���������ʵ������ͼ��

��1��ʵ���з��������ӷ�Ӧ��______________________
��2������������������г��ְ�ɫ���������ܳ��˵�����ͷ�� KClO3�Ĵ��ڣ���������________����ν���������____________
��3��ʵ���û��ͷ��KClO3����������Ϊ____________��δϴ�ӳ��������KClO3������������_________���� ��ƫ��������ƫС����������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�1��2���������飬�����������Ҵ����Ʊ���ϩ��������ϩ�����������Ʊ�1��2���������飬װ������ͼ��ʾ��
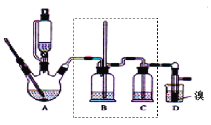
�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶȣ�g��cm��3 | 0��79 | 2��2 | 0��71 |
�е㣯�� | 78��5 | 132 | 34��6 |
�۵㣯�� | -130 | 9 | ��116 |
�ش��������⣺
��1���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����____��(����ȷѡ��ǰ����ĸ)
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��2����װ��A�г���Ũ������Ҵ��⣬��Ӧ����___����Ŀ����_____��װ��A�����ɸ��������ѵĻ�ѧ��Ӧ����ʽ ______��
��3��ʵ������ȡ��ϩ�������¶ȹ��߶�ʹ�Ҵ���ŨH2SO4��Ӧ���������Ķ�������Ϊ����֤��������Ĵ��ڲ���ȥ��������Ժ�����Ӧ�ĸ��ţ�ijͬѧ��A��D֮�������B��C����װ�ã�����B��C�пɷֱ�ʢ��_____
a������KMnO4��ˮ b��Ʒ���NaOH��Һ
c������KMnO4��NaOH��Һ d��Ʒ�������KMnO4
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��____��(����������������)�������������������������ѡ�����_____�ķ�����ȥ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com