
����Ŀ����ѧ��ҵ�л��������������ˮ��ֱ���ŷŻ������Ⱦ��
��1����ҵ�ϴ������Ժ�Cr2O72����ˮ�ķ������£�
��SO2��ԭ������1000L��0.002molL��1 Cr2O72�������Է�ˮ��ͨ��SO2ʹCr2O72��ȫ��ת��ΪCr3+ �� ������Ҫͨ��L SO2����״����
����м��ԭ������Cr2O72�������Է�ˮ�м������м�����ȳ�ַ�Ӧ������ʯ�ҵ�����Һ��pH��ʹCr3+��ȫ������
��֪25��ʱ��Ksp[Cr��OH��3]=6.3��10��31 �� ��ʹ��Һ�в���Cr3+�����ʵ���Ũ��Ϊ6.3��10��7 molL��1 �� Ӧ������Һ��pH= ��
��2����Ԫ����Ũ�ȵIJⶨ��ȷ��ȡ20.00mL��Cr2O72����Cr3+�����Է�ˮ�������м���������NH4��2S2O8��Һ��Cr3+������Cr2O72�� �� ��г�ȥ������NH4��2S2O8����������Һ�м��������KI��Һ����ַ�Ӧ���Ե���Ϊָʾ���������еμ�0.03molL��1��Na2S2O3����Һ���յ�ʱ����Na2S2O3��Һ20.00mL��
���������������У�������в�������ⶨ�ĸ�Ԫ����Ũ�Ȼ� ��
�ڼ����ˮ�и�Ԫ����Ũ�ȣ���λ��mgL��1 �� д��������̣�
��֪�ⶨ�����з����ķ�Ӧ���£�
��2Cr3++3S2O82��+7H2O=Cr2O72��+6SO42��+14H+
��Cr2O72��+6I��+14H+=2Cr3++3I2+7H2O
��I2+2S2O32��=2I��+S4O62�� ��
���𰸡�
��1��134.4��6
��2��ƫ�ߣ�Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 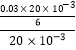 =0.005mol/L���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mg?L��1
=0.005mol/L���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mg?L��1
���������⣺��1����SO2ʹCr2O72��ȫ��ת��ΪCr3+ �� ����3SO2����Cr2O72�� ��
3��22.4L 1mol
V 1000L��0.002molL��1
����V= ![]() =134.4L�����Դ��ǣ�134.4��
=134.4L�����Դ��ǣ�134.4��
��Ksp[Cr��OH��3]=c��Cr3+��c3��OH����=6.3��10��31 �� ��ʹ��Һ�в���Cr3+�����ʵ���Ũ��Ϊ6.3��10��7 molL��1 �� ����c��OH����= ![]() =10��8mol/L��Ӧ������Һ��pOH=8����pH=6�����Դ��ǣ�6����2����������в������������NH4��2S2O8����Cr2O72�� �� ������ⶨ�ĸ�Ԫ����Ũ�Ȼ�ƫ�ߣ����Դ��ǣ�ƫ�ߣ�
=10��8mol/L��Ӧ������Һ��pOH=8����pH=6�����Դ��ǣ�6����2����������в������������NH4��2S2O8����Cr2O72�� �� ������ⶨ�ĸ�Ԫ����Ũ�Ȼ�ƫ�ߣ����Դ��ǣ�ƫ�ߣ�
���ɢ�2Cr3++3S2O82��+7H2O=Cr2O72��+6SO42��+14H+
��Cr2O72��+6I��+14H+=2Cr3++3I2+7H2O
��I2+2S2O32��=2I��+S4O62���ã�Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 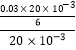 =0.005mol/L
=0.005mol/L
���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mgL��1 �� ��Cr2O72����3I2��6S2O32�� �� ���ݷ���ʽȷ����ϵCr2O72����3I2��6S2O32��
n��Cr2O72����= ![]() =
= ![]() mol������c��Cr2O72����=
mol������c��Cr2O72����= 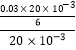 =0.005mol/L
=0.005mol/L
���Է�ˮ�и�Ԫ����Ũ��=0.005��2��52��1000=520 mgL��1 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ag/A12O3�����ڹ�ҵ�Ͼ��й㷺��;���������������Ļ��ռȿɽ�Լ��Դ�����нϺõľ���Ч�森�������ļ�������ͼ��ʾ�������������Լ��ԣ��� 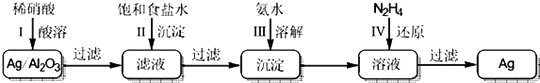
��ش��������⣺
��1���ڢ��У�����A12O3����ϡ���ᷴӦ��Ag��ϡ���ᷴӦ������������
��2���ڢ��У�����ʳ��ˮ�ɹ�ҵʳ��ˮ�ᴿ���ã���ȥ��ҵʳ��ˮ�е�����Na2SO4��MgC12��CaC12���ʣ���ȷ�IJ���˳����������ĸ��ţ���
a�������Թ�����NaOH��Һ b�������Թ�����BaC12��Һ c������
d�������Թ�����Na2CO3��Һ e��������������
��3����III���У����백ˮʹ�����ܽ�����ӷ���ʽ��
��4��N2H4���л�ԭ�ԣ���������ΪN2 �� ��IV����Ӧ�IJ����Ag��N2�⣬���е����������ѧʽ����
��5��N2H4����������ƽ�������֪��
N2H4��1��+O2��g��=N2��g��+2H2O��g����H=��534kJ/mol
2NO��g��+O2��g��=2NO2��g����H=��116kJ/mol
N2��g��+O2��g��=2NO��g����H=+183kJ/mol
N2H4��NO2��Ӧ����N2����̬H2O���Ȼ�ѧ����ʽ�� ��
��6��Ag���Ʊ���пŦ�۵����������Ag2O2 �� ���������¸õ�ص�������Ӧʽ�� ��
��7�������������еڢ����Ļ����ʾ�Ϊ90%��������a kg����b%�ķ�����������������Ҫ����N2H4��������kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��N2O4��NO�Ļ�����壬��Щ������1.68L O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣮ������������ͭ��Һ�м���5molL��1 NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ������ǣ�������
A.60 mL
B.45 mL
C.30 mL
D.15 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��H�������ʴ�������ͼ��ʾ��ת����ϵ����Ӧ���������ֲ���δ���������֪A����ʽ�Σ�B��ʹƷ����Һ��ɫ��G�Ǻ���ɫ���壬D��H��ͬһ�����ʣ� 
�Իش��������⣺
��1��д�����и����ʵĻ�ѧʽ��A��H ��
��2����Ҫ��д�����з�Ӧ���йط���ʽ ��A��E��Ӧ�����ӷ���ʽ��
��E��F ��Ӧ�Ļ�ѧ����ʽ��
��3�������¿�������������ʢװŨD������Ϊ �� ����������100mlŨH��ֱ�����������Ⱥ�˳��д����������Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1����ϵͳ������������ ���л���CH3CH��C2H5��CH��CH3��2�������� ��
�����л����������ijһ��̼ԭ������4����ͬ��ԭ�ӻ���ţ�������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ��� C7H16��ͬ���칹���о��С�����̼ԭ�ӡ������֣�д������һ�ֵ����� ��
��2��д�����и����л���Ľṹ��ʽ ��2��3��������4���һ�����
��֧��ֻ��һ���һ���ʽ����С������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߡ������й����dz��õ�Ԫ�����ڱ���˵����ȷ���ǣ� ��
A. Ԫ�����ڱ���18�����У�����16����
B. �ϳ�����ũҩ������Ԫ�����ڱ��Ľ�����ǽ������紦����̽Ѱ
C. ��������ָ��һ����������������
D. IA���Ԫ��ȫ���ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������ǣ�������
A.2 mol H2O��Ħ��������1mol H2O��Ħ������
B.200 mL 1 molL��1�Ȼ�����Һ��c��Cl������100 mL 2 molL��1�Ȼ�����Һ��c��Cl����
C.64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D.20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȴ��ġ����������������һϵ�б���������������Ӧ�������γɵģ���ͼ��ʾ����������л����˵����ȷ���ǣ� �� 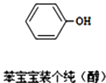
A.̼ԭ�Ӳ���sp3�ӻ�
B.��ԭ�Ӳ���sp2�ӻ�
C.���л������ڴ���
D.�÷����е�13��ԭ���п��ܴ���ͬһƽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com