
| A、60mL | B、240mL |
| C、30mL | D、120mL |
| n |
| c |
| 3.36L |
| 22.4L/mol |
| 0.15mol×4 |
| 2 |
| 0.6mol |
| 2.5mol/L |


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、2SO2+O2?2SO3 |
| B、I2(g)+H2?2HI |
| C、CO2+H2O=H2CO3 |
| D、H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
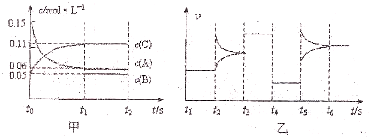
| A、若t1=15s,生成物C在t0-t1时间段的平均反应速率为0.004 mol?L-1?S-1 |
| B、t4-t5阶段改变的条件为降低反应温度 |
| C、B的起始物质的量为0.02 mol |
| D、t5-t6阶段改变的条件是增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4和Fe的混合物 |
| B、Fe3O4和FeO的混合物 |
| C、Fe3O4和Fe2O3的混合物 |
| D、Fe3O4、FeO和Fe的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3[Al(OH)3] |
| B、MgCl2(AlCl3) |
| C、Fe(Al) |
| D、MgO(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| B、裂解、煤的汽化、石油减压分馏、甲苯制TNT等过程中都包含化学变化 |
| C、需要通电才可进行的有:电离、电解、电镀、电化学腐蚀 |
| D、乙醇和乙烯的物质的量均为1mol,完成燃烧消耗的氧气的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鱼、肉、鸡蛋等富含蛋白质的食品被称为碱性食品,长期缺乏可使尿液偏酸性 |
| B、维生素C在水溶液中或受热时容易被氧化,生吃新鲜蔬菜可以减少维生素C的损失 |
| C、血红蛋白与CO结合生成碳氧血红蛋白,强于结合O2的能力,CO可使人缺氧中毒 |
| D、水中的无机汞在微生物作用下会转化成毒性更大的有机汞,日本的水俣病就是有机汞引起的汞中毒事件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Na2CO3都属于碱 |
| B、HNO3、HClO都属于酸 |
| C、SO2、CO都属于酸性氧化物 |
| D、H2SO4、SO3都属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度T(K) | 273K | 323K | 373K |
| 平衡常数 | 0.005 | 0.022 | 0.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com