
【题目】氮及其化合物的转化过程如图所示。下列分析不合理的是
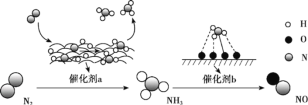
A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.催化剂不能改变反应焓变但可降低反应活化能
C.在催化剂 b 表面形成氮氧键时,涉及电子转移
D.催化剂 a、b 能提高反应的平衡转化率
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所做出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,浓度均为1mol·L1的CH3COOH和HCl分别做导电性实验,CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向浓度均为0.1 mol·L1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 分别向pH=3的盐酸和草酸溶液中加入足量锌粒,一段时间后草酸反应速率更快 | 草酸是二元酸 |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH为10;0.1 molL-1 NaHSO3溶液pH为5 | HSO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是

A. 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B. 由图Ⅱ可知图中a>c
C. 由图Ⅰ可知温度:T1>T2>T3
D. 由图Ⅰ可知上述反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数表达式为__。
2NH3(g)的化学平衡常数表达式为__。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是__。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g)+O2(g) | 5×10-31 |
② | N2(g)+3H2(g) | 4.1×106 |
(3)某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L的反应物进行合成氨反应,N2的浓度随时间的变化如图①、②、③曲线所示。
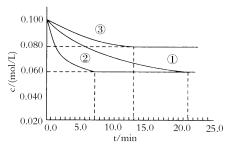
实验②平衡时H2的转化率为__。
据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:___理由:___。
③条件:___理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
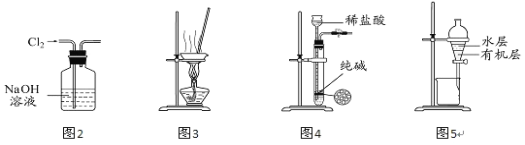
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常为+3价,这些化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)镓元素(Ga)的原子序数为__________,其外围电子排布式__________。
(2)由第二周期元素组成的与BCl3互为等电子体的阴离子为________。 硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—。不考虑空间构型,[B(OH)4]—中原子的成键方式用结构简式表示为______________。1 mol [B(OH)4]—中σ键的数目为________。
(3)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因______________。
(4)磷化铝熔点为2000℃,空间结构与金刚石相似,磷化铝晶胞结构如图所示。
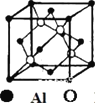
①磷化铝晶体中磷与铝微粒间的作用力为__________。
②磷化铝晶体的密度为ρ g·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为__________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
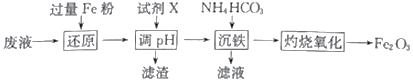
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com