
����Ŀ����������ʵ������������������Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | ��ͬ�����£�Ũ�Ⱦ�Ϊ1mol��L1��CH3COOH��HCl�ֱ���������ʵ�飬CH3COOH��Һ��Ӧ�ĵ��ݽϰ� | CH3COOH��������� |
B | ��Ũ�Ⱦ�Ϊ0.1 mol��L1��MgCl2��CuCl2�����Һ����μ��백ˮ���ȳ�����ɫ���� | Ksp[Mg(OH)2]��Ksp[Cu(OH)2] |
C | �ֱ���pH��3������Ͳ�����Һ�м�������п����һ��ʱ�����ᷴӦ���ʸ��� | �����Ƕ�Ԫ�� |
D | �����£���pH��ֽ��ã�0.1 molL��1 Na2SO3��Һ��pHΪ10��0.1 molL��1 NaHSO3��ҺpHΪ5 | HSO |
A.AB.BC.CD.D
���𰸡�A
��������
A����Ũ��ʱ������ȫ���룬���Ჿ�ֵ��룬��CH3COOH��Һ��Ӧ�ĵ��ݽϰ����ܹ�˵��CH3COOH��������ʣ���A��ȷ��
B��KspС���ȳ�������Ũ�Ⱦ�Ϊ0.1 mol��L1��MgCl2��CuCl2�����Һ����μ��백ˮ���ȳ�����ɫ������˵��Ksp[Mg(OH)2]��Ksp[Cu(OH)2]����B����
C��pH=3������Ͳ��ᣬ����Ũ�ȴ����ŷ�Ӧ�Ľ��У�����������룬һ��ʱ�����ᷴӦ���ʱ�����죬ֻ��˵������Ϊ���ᣬ����˵������Ϊ��Ԫ�ᣬ��C����
D��0.1 molL��1 Na2SO3��Һ��pHΪ10��0.1 molL��1 NaHSO3��ҺpHΪ5��˵��Na2SO3��Һˮ���Լ��ԣ�NaHSO3��Һ���������ԣ���HSO3-���H+��������SO32-��������D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������нϹ㷺�Ŀ������ã���ṹ��ʽ����ͼ��ʾ��

���ڿ������������������ȷ����(����)
A������ʽΪC16H13O9
B��1 mol����������뺬8 mol NaOH����Һ��Ӧ
C����ʹ����KMnO4��Һ��ɫ��˵�����ӽṹ�к���̼̼˫��
D����Ũ��ˮ�ܷ����������͵ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ����ñ���ͪ��ӵ��������ϳɱ����ᣬԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
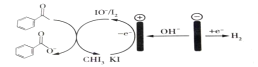
A.���װ���ǽ���ѧ��ת��Ϊ����
B.������Ӧ��2H++2e�TH2��
C.����I-ʧȥ���Ӻ�IJ�����OH-��Ӧ�����ӷ���ʽΪI2+2OH-=I-+IO-+H2O
D.��װ����Ҫ������������Һ������KI��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���
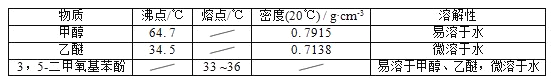
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ������ǣ���
A.�ö��Ե缫��ⱥ��ʳ��ˮ��2Cl-+2H2O![]() 2OH-+Cl2��+H2��
2OH-+Cl2��+H2��
B.�����������ϡ����ķ�Ӧ��S2O32-+6H++2SO42-=4SO2��+3H2O
C.��������Һ�ʼ��Ե�ԭ��CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.����ͭ��Һ�������ܵ�PbSת��Ϊ�����ܵ�CuS��Cu2++SO42-+PbS=CuS+PbSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ֻ�����Ľṹ��ͼ��ʾ������X��Y��Z��Q��WΪԭ������������������ֶ�����Ԫ�أ�Q����������������Y�������������ͬ��X��ԭ�Ӱ뾶��Ԫ�����ڱ�����С�ġ�����������ȷ����
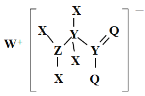
A.Z������������Ӧ��ˮ������һԪǿ��
B.WX��ˮ��Һ������
C.Ԫ�طǽ����Ե�˳��ΪY��Z��Q
D.�û���������Y����������Q������8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������ŵ����2020�꣬��λGDP CO2�ŷ�����2005���½�40%��45%����ش��������⣺
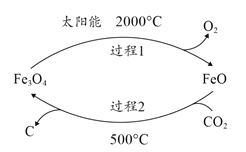
(1)����̫���ܹ��տɽ�Fe3O4ת��ΪFeO��Ȼ������FeO����CO2�ɵ�̿�ڣ�����������ͼ��ʾ����ѭ����Fe3O4����Ϊ_______��������������м�����������2����1mo1CO2ת�Ƶ��ӵ����ʵ�����_______mol��
(2)��CO2��NH3Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ����:
2NH3(g)��CO2(g)��H2NCOONH4(s) ��H����1595kJ��mol��1
H2NCOONH4 (s)��CO(NH2)2(s)��H2O(g) ��H����1165kJ��mol��1
H2O(l)��H2O(g) ��H����44.0kJ��mol��1
CO2(g)��NH3(g)�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ_______________________��
(3)CH4-CO2���������Եõ�ȼ��CO��H2��һ���������ں��ݵ��ܱ������з�����Ӧ��CO2(g)��CH4(g)![]() 2CO(g)��2H2(g)�ܹ�˵��������Ӧ�Ѵﵽƽ��״̬����______������ĸ��ţ���
2CO(g)��2H2(g)�ܹ�˵��������Ӧ�Ѵﵽƽ��״̬����______������ĸ��ţ���
A��CO2��CH4��Ũ�����
B��v��(CO2)��2v��(CO)
C��ÿ����4molC��H����ͬʱ������2molH��H��
D�������л�������ƽ����Է����������ֲ���
E�������л��������ܶȱ��ֲ���
(4)CO2��һ���������壬���䱾��������������ʱ����һЩ�ж�����ת��ΪCO2��һ���¶��£��������ݻ���Ϊ2.0 L���ܱ������з�����Ӧ��2NO(g)��2CO(g)![]() N2(g)��2CO2(g)
N2(g)��2CO2(g)
��ͬ�¶��£������и�������ʼ��ƽ��ʱ�����ʵ������±���ʾ��
���� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
NO(g) | CO(g) | CO2 | ||
�� | 50 | 0.2 | 0.2 | 0.12 |
�� | 100 | 0.2 | 0.2 | 0.1 |
�� | 100 | 0.3 | 0.3 | |
����˵����ȷ����___________
A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B��50��ʱ������ʼʱ����г���0.1 mol N2��0.2 mol CO2�����ƽ��ʱN2��ת����Ϊ40%
C��100��ʱ������ʼʱ�����г����NO��CO��N2��CO2��Ϊ0.40 mol�����ʱv����v��
D���ﵽƽ��ʱ������CO2��������������е�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪԭ��������������Ķ�����Ԫ�أ�Y��WΪͬһ����Ԫ����Wԭ�ӵ���������������Yԭ�ӵĺ���������������γɵ�һ�ֻ�����ṹ��ͼ��ʾ������������ȷ����
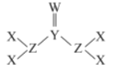
A.ԭ�Ӱ뾶:W>Z>Y>X
B.�û������и�Ԫ�ص�ԭ������������8���ӽṹ
C.X��Y�γɵĶ�Ԫ�����ﳣ����һ��Ϊ��̬
D.X��Y��Z��W���γ�ԭ�Ӹ�����8��1��2��3�Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ת��������ͼ��ʾ�����з�������������
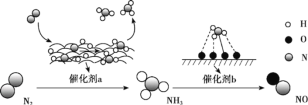
A.���� a ���淢���˷Ǽ��Թ��ۼ��Ķ��Ѻͼ��Թ��ۼ����γ�
B.�������ܸı䷴Ӧ�ʱ䵫�ɽ��ͷ�Ӧ���
C.�ڴ��� b �����γɵ�����ʱ���漰����ת��
D.���� a��b ����߷�Ӧ��ƽ��ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com