
【题目】我国政府承诺,到2020年,单位GDP CO2排放量比2005年下降40%-45%。请回答下列问题:
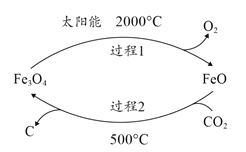
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为_______(填“催化剂”、“中间产物”),过程2捕获1mo1CO2转移电子的物质的量是_______mol。
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式_______________________;
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡时物质的量/mol | |
NO(g) | CO(g) | CO2 | ||
甲 | 50 | 0.2 | 0.2 | 0.12 |
乙 | 100 | 0.2 | 0.2 | 0.1 |
丙 | 100 | 0.3 | 0.3 | |
下列说法正确的是___________
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小
【答案】催化剂 4 2NH3(g)+CO2(g) = CO(NH2)2(s)+H2O(l) △H=-474 kJ·mol-1 CD BC
【解析】
(1) 利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,结合流程图写出反应的总反应,据此分析解答;
(2)首先写出CO2(g)与NH3(g)合成尿素的化学方程式,再根据盖斯定律分析解答;
(3)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,据此分析判断;
(4)A.根据温度对平衡的影响分析判断;B.50℃时,起始甲中充入0.1molN2和0.2molCO2所达到的平衡状态与50℃时,起始甲中充入0.2molNO和0.2molCO所达到的平衡状态是等效平衡,利用甲的反应三段式计算;C.根据乙的反应三段式计算平衡常数K,结合浓度商Qc与K的关系判断反应进行的方向;D.同比增大NO、CO的浓度,相当于加压,根据增大压强对化学平衡的影响分析判断。
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,由流程图可知总反应为CO2![]() C+O2,在500℃条件下,过程2中CO2和FeO发生反应生成的Fe3O4是过程1中的反应物,所以该循环中Fe3O4可视为催化剂,过程2的反应为6FeO+CO2=2Fe3O4+C,C的化合价降低4,即转移4e-,所以捕获1mo1CO2转移电子的物质的量为4mol,故答案为:催化剂;4;
C+O2,在500℃条件下,过程2中CO2和FeO发生反应生成的Fe3O4是过程1中的反应物,所以该循环中Fe3O4可视为催化剂,过程2的反应为6FeO+CO2=2Fe3O4+C,C的化合价降低4,即转移4e-,所以捕获1mo1CO2转移电子的物质的量为4mol,故答案为:催化剂;4;
(2)CO2(g)与NH3(g)合成尿素的化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s) +H2O(l);①2NH3(g)+CO2(g)═H2NCOONH4(s) △H=-1595kJmol-1,②H2NCOONH4 (s)═CO(NH2)2(s)+H2O(g) △H=+1165kJmol-1,③H2O(l)═H2O(g) △H=+44.0kJmol-1,根据盖斯定律,将①+②-③得:2NH3(g)+CO2(g)=CO(NH2)2(s) +H2O(l) △H=-1595kJmol-1+(+1165kJmol-1) -(+44.0kJmol-1)=-474 kJmol-1,即2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-474 kJmol-1 ,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-474 kJmol-1 ;
(3)A.反应达到平衡时,CO2和CH4的浓度不变,但不一定相等,所以该状态不能判定反应达到平衡状态,故A错误;B.反应达到平衡时v正(CO2)∶v逆(CO)=1∶2,即2v正(CO2)=v逆(CO),所以v正(CO2)=2v逆(CO)的状态不是平衡状态,实际上此时反应正向进行,故B错误;C.每断裂4molC-H键的同时,断裂2molH-H键,即2v正(CH4)=v逆(H2),符合v正(CH4)∶v逆(H2)=1∶2,说明正逆反应速率相等,为平衡状态,故C正确;D.反应体系中各物质均为气体,混合气体的总质量不变,气体总物质的量n是变化的,根据M=![]() 可知,容器中混合气体的平均相对分子质量保持不变的状态是平衡状态,故D正确;E.反应体系中各物质均为气体,混合气体的总质量不变,所以恒温恒容条件下容器中混合气体的密度ρ=
可知,容器中混合气体的平均相对分子质量保持不变的状态是平衡状态,故D正确;E.反应体系中各物质均为气体,混合气体的总质量不变,所以恒温恒容条件下容器中混合气体的密度ρ=![]() 始终保持不变,不能判定反应是否达到平衡状态,故E错误;故答案为:CD;
始终保持不变,不能判定反应是否达到平衡状态,故E错误;故答案为:CD;
(4)A.将甲的平衡状态升温到100℃时,n(CO2)减少,说明升高温度,平衡逆向移动,正反应放热,故A错误;
B.

50℃时,若起始甲中充入0.1molN2和0.2molCO2达到的平衡状态与起始甲中充入0.2molNO和0.2molCO所达到的平衡状态是等效平衡,即达到平衡状态时c(N2)=0.03mol/L,n(N2)=0.06mol,所以达平衡时N2的转化率=![]() ×100%=40%,故B正确;
×100%=40%,故B正确;
C.100℃时,
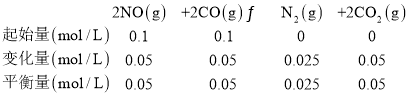
平衡常数K=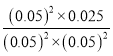 =10,若起始时向乙中充入的NO、CO、N2和CO2均为0.40mol,即浓度均为0.2mol/L时,浓度商Qc=
=10,若起始时向乙中充入的NO、CO、N2和CO2均为0.40mol,即浓度均为0.2mol/L时,浓度商Qc=![]() =5<10=K,所以反应正向进行,此时v正>v逆,故C正确;
=5<10=K,所以反应正向进行,此时v正>v逆,故C正确;
D.反应2NO(g)+2CO(g)N2(g)+2CO2(g)正向气体体积减小,增大压强时平衡正向移动,c(CO2)增大,丙容器反应体系相当于乙容器加压,平衡正向移动,c(CO2)增大,所以达到平衡时,丙中CO2的体积分数比乙中的大,故D错误;故答案为:BC。


科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂硫胺(Cinanserin)是上世纪70年代用于抗精神分裂症的药物,对冠状病毒3CL水解酶具有抑制作用,下图是其合成路线图。

已知以下信息:
①A为常见的烃,它对H2的相对密度为39
②2RCOOH RCH2OH
RCH2OH
③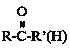 +HCN
+HCN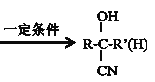
回答下列问题:
(1)A的名称__________;B的结构简式___________;肉桂硫胺中含氧官能团的名称__________。
(2)步骤①的反应方程式________________,其反应类型为_________。
(3)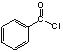 中共平面的原子最多________个。
中共平面的原子最多________个。
(4)M是C的同分异构体,符合下列条件的M有_______种。
①属于芳香族化合物。②能发生银镜反应。
(5)参照题干,写出由![]() 制备
制备![]() 的流程图。_______。
的流程图。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所做出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,浓度均为1mol·L1的CH3COOH和HCl分别做导电性实验,CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向浓度均为0.1 mol·L1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 分别向pH=3的盐酸和草酸溶液中加入足量锌粒,一段时间后草酸反应速率更快 | 草酸是二元酸 |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH为10;0.1 molL-1 NaHSO3溶液pH为5 | HSO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳纳米管能够吸附氢气,设计一种新型二次电池,其装置如图所示。关于该电池的叙述不正确的是( )
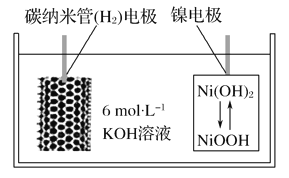
A. 电池放电时K+移向正极
B. 电池放电时负极反应为:H2-2e-+2OH-===2H2O
C. 电池充电时镍电极上NiOOH转化为Ni(OH)2
D. 电池充电时碳纳米管电极与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国《食品添加剂使用卫生标准》中规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
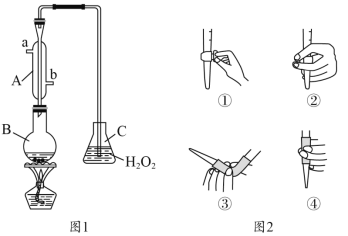
(1)仪器B的名称是__________,冷却水的进口为________。(填“a”或“b”)
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________。
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若选择酚酞为指示剂,则滴定终点的现象为_____________________;
(4)经3次平行实验,消耗NaOH溶液体积如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
该葡萄酒中SO2含量为______________g·L-1(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠(Na2SnO3·xH2O)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,—种由锡精矿制备锡酸钠的工艺流程如下:
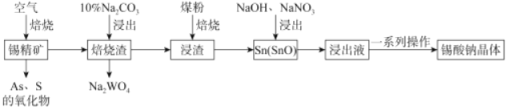
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为_____________。
(2)从“焙烧渣”中除去Fe3O4最简单的方法为_____________。加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO。在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___________________。
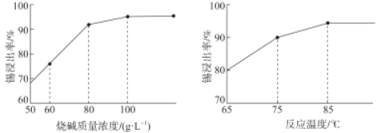
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为_____________、___________,
(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___________、洗涤、干燥。
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为__________。
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
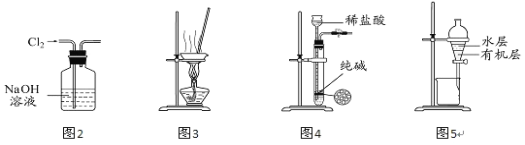
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com