
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ���ش��������⣺ 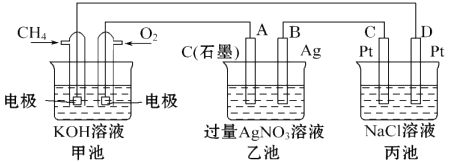
��1����װ����ͨ��CH4�ĵ缫��ӦʽΪ ��
��2��������ת���ĽǶȷ������ҳ���ת��Ϊ��װ�ã�
��3��һ��ʱ�䣬�������в���112mL����״���£�����ʱ�����Ƚ�����أ�������Һ��25��ʱ�����ʵ���Ũ��Ϊ �� ����֪��NaCl��Һ������������Һ���Ϊ500mL����
��4����Ҫʹ���ػָ����ǰ��״̬��Ӧ�������ͨ����д��ѧʽ����
���𰸡�
��1��CH4+10OH����8e��?CO3 2��+7H2O
��2�����ܣ���ѧ��
��3��0.01mol/L
��4��HCl
���������⣺��1.������ԭ��أ�ͨ�����ĵ缫�Ǹ����������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪCH4+10OH����8e��CO3 2��+7H2O�����Դ��ǣ�CH4+10OH����8e��CO3 2��+7H2O��
��2.���ҳ��ǵ��أ�������ת��Ϊ��ѧ�ܣ����Դ��ǣ����ܣ���ѧ�ܣ�
��3.�������ǵ��أ�C�缫����������D�缫�����������������������������ʵ���֮��Ϊ1��1�������������ʵ���= ![]() =0.0025mol������������NaOH��ϵʽ��n��NaOH��=2n��Cl2��=2��0.0025mol=0.005mol�������c��NaOH���T
=0.0025mol������������NaOH��ϵʽ��n��NaOH��=2n��Cl2��=2��0.0025mol=0.005mol�������c��NaOH���T ![]() =0.01mol/L�����Դ��ǣ�0.01mol/L��
=0.01mol/L�����Դ��ǣ�0.01mol/L��
��4.�����������������������������������൱�������Ȼ��⣬��������ʲô����ʲôԭ��֪��ͨ��HCl������ʹ��Һ�ָ�ԭ״�����Դ��ǣ�HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
��Fe��OH��3�����CuSO4��Һ���ǻ����
��BaSO4��һ��������ˮ��ǿ�����
���û���Ӧ���������ӷ�Ӧ
�ܱ����ᡢ���С�մ�ֱ������ᡢ���
A. �ڢ� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж����������л�ѧ��Ӧԭ���ķ�����ȷ���� ( )��
A.�����������漰��������ѧ��Ӧ��ԭ�ϵIJ�ͬ����ȫ���Ƿ�������ԭ��Ӧ
B.�����������漰��������ѧ��Ӧ���Ƿ��ȷ�Ӧ
C.�����������漰��������ѧ��Ӧ����Ҫʹ�ô���
D.�����������漰��������ѧ��Ӧ����Ҫ�ڽϸ��¶������½���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������Ӧ����( )
A.���������ڼ��������µ�ˮ��
B.Ӳ֬������������������µ�ˮ��
C.��֬��������ڼ��������µ�ˮ��
D.��������������������µ�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ����ͼ��ʾ������˵����ȷ���ǣ� ��
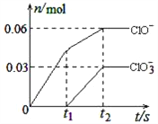
A. ���Լ���Һ��KOH�����ʵ�����0.09mol
B. ClO3�����������������������Ķ��������
C. ������������ClO����ClO3��������Cl2
D. ��Ӧ��ת�Ƶ��ӵ����ʵ�����0.21mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����X��Y�������ij�ܱ������У���һ�������£��������·�Ӧ���ﵽƽ�⣺
X(g)+ 3Y(g) ![]() 2Z(g) ��H<0 ���ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����
2Z(g) ��H<0 ���ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����
ѡ�� | �ı����� | ��ƽ����ԭƽ��Ƚ� |
A | �����¶� | X��ת���ʱ�С |
B | ����ѹǿ | X��Ũ�ȱ�С |
C | ����һ����Y | Y��ת�������� |
D | ʹ���ʵ����� | X�����������С |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʊ�ԭ������ȷ���ǣ� ��
A.������N2+3H2![]() 2NH3
2NH3
B.�裺SiO2+2C![]() Si+2CO��
Si+2CO��
C.��ϩ��2C2H5OH![]() CH2=CH2��+H2O
CH2=CH2��+H2O
D.Ư�ۣ�2Ca��OH��2+2Cl2=Ca��ClO��2+CaCl2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����80��ʱ����0.40 mol��N2O4�������2 L�Ѿ������յĹ̶��ݻ����ܱ������У�������ӦN2O4(g)![]() 2NO2(g)����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20��40 s����N2O4��ʾ��ƽ����Ӧ����Ϊ ___________mol L-1��s-1
��2��������80��ʱ�÷�Ӧ��ƽ�ⳣ��K =____________(��ע����λ)��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ________(������dz������������������)��
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ��_________(����ĸ����)
A.����N2O4��ʼŨ��
B.����������ͨ��NO2
C.ʹ�ø�Ч����
D.�����¶�
��5����ͼ��80��ʱ������N2O4���ʵ����ı仯���ߣ����ڸ�ͼ�в������÷�Ӧ��60��ʱN2O4���ʵ����ı仯����_________��
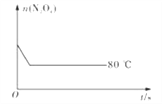
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ʽ�ɼ���������Ԫ�ؼ��仯��������ʡ���֪��������ԭ��Ӧ��
2FeCl3��2HI===2FeCl2��I2��2HCl 2Co(OH)3��6HCl===2CoCl2��Cl2����6H2O
2Fe(OH)2��I2��2KOH===2Fe(OH)3��2KI 3I2��6KOH===5KI��KIO3��3H2O
���ֽⷴӦ��
2HSCN��K2CO3===2KSCN��CO2����H2O KCN��CO2��H2O===HCN��KHCO3
�ȷֽⷴӦ��
4NaClO![]() 3NaCl��NaClO4 NaClO4
3NaCl��NaClO4 NaClO4![]() NaCl��2O2��
NaCl��2O2��
����˵������ȷ����
A. ������(������Һ)��FeCl3>Co(OH)3>I2 B. ��ԭ��(������Һ)��Fe(OH)2>I2>KIO3
C. ���ȶ��ԣ�NaCl>NaClO4>NaClO D. ����(ˮ��Һ)��HSCN>H2CO3>HCN
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com