
【题目】在80℃时,将0.40 mol的N2O4气体充入2 L已经抽成真空的固定容积的密闭容器中,发生反应N2O4(g)![]() 2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为 ___________mol L-1·s-1
(2)计算在80℃时该反应的平衡常数K =____________(请注明单位)。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变)。
(4)要增大该反应的K值,可采取的措施有_________(填字母代号)
A.增大N2O4起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线_________。
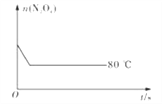
【答案】 0.0020 1.8mol·L-1 变浅 D 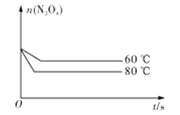
【解析】试题分析:(1)N2O4的速率=(0.40-0.20)mol÷2L÷20s=0.0020 mol·L-1·s-1;(2) 根据方程式:N2O4![]() 2NO2
2NO2
初始物质的的量 0.4 0
改变物质的量 x 2x
平衡物质的量 0.4-x 0.6 列式计算 2x=0.6 x=0.3 平衡时N2O4的物质的量为0.4-0.3=0.1mol,平衡常数=c(NO2)2÷c(N2O4)=(0.6÷2)2÷(0.1÷2)=1.8 mol·L-1;(3)降低温度,平衡向放热方向移动,故向逆向移动,二氧化氮浓度减小,颜色变浅;(4)化学平衡常数只有温度有关,升温,平衡正向移动,化学平衡常数增大;(5)反应在60℃时,反应速率减慢,N2O4物质的量变化缓慢,达到平衡所需要的时间长,温度低有利于平衡逆向移动,N2O4物质的量比80℃时的多,故画图为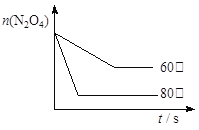


科目:高中化学 来源: 题型:
【题目】下列制取单质的反应中,化合物作还原剂的是
A. 用铝和氧化铁在高温下反应制取铁
B. 用溴和碘化钾溶液反应制取碘
C. 用碳和高温水蒸汽反应制取氢气
D. 用氢气和灼热的氧化铜反应制取铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题: 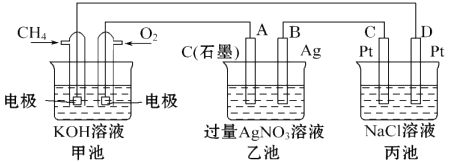
(1)甲装置中通入CH4的电极反应式为 ,
(2)从能量转化的角度分析,乙池是转化为的装置.
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为 . (己知:NaCl溶液足量,电解后溶液体积为500mL).
(4)若要使丙池恢复电解前的状态,应向丙池中通入(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
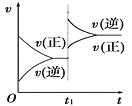
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 红磷和白磷互为同素异形体 B. CH3CH2OH与CH3OCH3互为同分异构体
C. 12C和14C互为同位素 D. 核素21H的中子数为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,按要求填空( 填元素符号或化学式):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①元素的元素名称 .
(2)写出⑩元素的元素符号 .
(3)⑨在元素周期表中的位置:第周期,第族.
(4)在这些元素中,是最活泼的金属元素;是最活泼的非金属元素;是最不活泼的元素.(用元素符号填写)
(5)能形成气态氢化物,且气态氢化物最稳定的是 . (用化学式填写)
(6)这些元素的最高价氧化物对应水化物中最强的酸是;最强的碱是;具有两性的氢氧化物是 . (用化学式填写)
(7)从⑤到的元素中,原子半径最小.(用元素符号填写)
(8)比较⑤与⑥的化学性质,更活泼(用元素符号填写),试用实验证明此现象(简述实验操作、现象和结论) .
(9)用电子式表示元素④与⑥形成的化合物: , 该化合物属于(填“共价”或“离子”)化合物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=12的溶液中能大量共存的离子组是
A.Na+、K+、HSO3-、NO3-
B.Mg2+、ClO-、Na+、Cl-
C.Fe3+、Na+、SCN-、SO42-
D.MnO4-、NO3-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
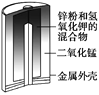
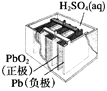
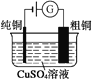
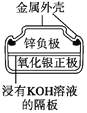
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2B.Cu和Cl2C.H2和O2D.Cu和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com