
����Ŀ�������Ԫ�����ڱ���һ���֣���Ҫ����գ� ��Ԫ�ط��Ż�ѧʽ����
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� | �� |
��1��д����Ԫ�ص�Ԫ������ ��
��2��д����Ԫ�ص�Ԫ�ط��� ��
��3������Ԫ�����ڱ��е�λ�ã������ڣ����壮
��4������ЩԪ���У�������õĽ���Ԫ�أ�������õķǽ���Ԫ�أ�������õ�Ԫ�أ�����Ԫ�ط�����д��
��5�����γ���̬�⻯�����̬�⻯�����ȶ����� �� ���û�ѧʽ��д��
��6����ЩԪ�ص�����������Ӧˮ��������ǿ����������ǿ�ļ������������Ե����������� �� ���û�ѧʽ��д��
��7���Ӣݵ���Ԫ���У�ԭ�Ӱ뾶��С������Ԫ�ط�����д��
��8���ȽϢ���Ļ�ѧ���ʣ������ã���Ԫ�ط�����д��������ʵ��֤����������ʵ�����������ͽ��ۣ� ��
��9���õ���ʽ��ʾԪ�آ�����γɵĻ���� �� �û���������������ۡ������ӡ��������
���𰸡�
��1��̼
��2��S
��3��������A
��4��Na��F��Ar
��5��HF
��6��HClO4��NaOH��Al��OH��3
��7��Cl
��8��Na���ֱ��ƺ�þͶ����ˮ�У��ƾ��ҷ�Ӧ��þ������Ӧ��˵���ƽ����Ա�þǿ
��9��![]() ������
������
���������⣺����Ԫ���������ڱ��е�λ�ò����жϢٵ���Ԫ������Ϊ��C��N��O��F��Na��Mg��Al��Si��P��S��Cl��Ar.
��1.����Ϊ̼�����Դ��ǣ�̼��
��2.����ΪS�����Դ��ǣ�S��
��3.����ΪP��λ�����ڱ��е������ڵ�VA�壬���Դ��ǣ�����VA��
��4.��ͬ���ڴ����ң��������������ǽ���������ǿ����ϡ�������⣩��ͬ������ϵ��£���������ǿ���ǽ����Լ�����������õĽ���Ԫ��ΪNa������õķǽ���Ԫ��ΪF������õ�Ԫ��ΪAr�����Դ��ǣ�Na�� F��Ar��
��5.���ǽ�����Խǿ����̬�⻯��Խ�ȶ�����HF���ȶ������Դ��ǣ�HF��
��6.���ǽ�����Խǿ����̬�⻯��Խ�ȶ�������������Ӧˮ���������Խǿ��������Խǿ������������Ӧˮ����ļ���Խǿ����������ǿ����HClO4 �� ������ǿ����NaOH��������������ΪAl��OH��3 �� ���Դ��ǣ�HClO4��NaOH��Al��OH��3��
��7.��һ����Ӳ���Խ��뾶Խ����ͬ���Ӳ�����ԭ������ԽС�뾶Խ�ݵ���Ԫ����Cl�뾶��С�����Դ��ǣ�Cl��
��8.������Ļ�ѧ����Na����ã��ֱ��ƺ�þͶ����ˮ�У��ƾ��ҷ�Ӧ��þ������Ӧ��˵���ƽ����Ա�þǿ�����Դ��ǣ�Na���ֱ��ƺ�þͶ����ˮ�У��ƾ��ҷ�Ӧ��þ������Ӧ��˵���ƽ����Ա�þǿ��
��9.��������γɵĻ�����ΪMgF2 �� Ϊ���ӻ���������Ӻ�þ����ͨ�����Ӽ��γ����ӻ��������þ�����γɹ���Ϊ ![]() ��
��
���Դ��ǣ� ![]() �����ӣ�
�����ӣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������Ԫ��a��b��c��ԭ��������������,a��bͬ����,��b�ĺ˵������a����������2��������˵����ȷ����
A. b�ĺ���������Ա�c�ĺ������������
B. a��b�γɵĹ��ۻ������ڳ�����Ϊ����
C. ba2��c2������Ư�������ʹ��Ч�������
D. bac2��ˮ�з���ˮ�⣬��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����X��Y�������ij�ܱ������У���һ�������£��������·�Ӧ���ﵽƽ�⣺
X(g)+ 3Y(g) ![]() 2Z(g) ��H<0 ���ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����
2Z(g) ��H<0 ���ı�ij��������ά��������ֱ���µ�ƽ��ʱ���±��й�����ƽ����ԭƽ��ıȽ���ȷ����
ѡ�� | �ı����� | ��ƽ����ԭƽ��Ƚ� |
A | �����¶� | X��ת���ʱ�С |
B | ����ѹǿ | X��Ũ�ȱ�С |
C | ����һ����Y | Y��ת�������� |
D | ʹ���ʵ����� | X�����������С |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��CH3OH��g��+H2O��g���TCO2��g��+3H2��g����H=+49.0kJmol��1
��CH3OH��g��+ ![]() O2��g���TCO2��g��+2H2��g����H=��192.9kJmol��1
O2��g���TCO2��g��+2H2��g����H=��192.9kJmol��1
����˵����ȷ���ǣ� ��
A.CH3OH��ȼ����Ϊ192.9 kJmol��1
B.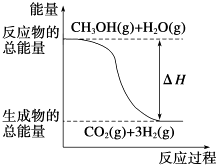
��Ӧ���е������仯��ͼ��ʾ
C.CH3OHת���H2�Ĺ���һ��Ҫ��������
D.���ݢ���֪��ӦCH3OH��l��+ ![]() O2��g���TCO2��g��+2H2��g���ġ�H����192.9 kJmol��1
O2��g���TCO2��g��+2H2��g���ġ�H����192.9 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����80��ʱ����0.40 mol��N2O4�������2 L�Ѿ������յĹ̶��ݻ����ܱ������У�������ӦN2O4(g)![]() 2NO2(g)����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20��40 s����N2O4��ʾ��ƽ����Ӧ����Ϊ ___________mol L-1��s-1
��2��������80��ʱ�÷�Ӧ��ƽ�ⳣ��K =____________(��ע����λ)��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ________(������dz������������������)��
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ��_________(����ĸ����)
A.����N2O4��ʼŨ��
B.����������ͨ��NO2
C.ʹ�ø�Ч����
D.�����¶�
��5����ͼ��80��ʱ������N2O4���ʵ����ı仯���ߣ����ڸ�ͼ�в������÷�Ӧ��60��ʱN2O4���ʵ����ı仯����_________��
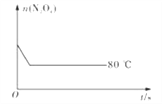
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ǧ���ص�Ǧ��(PbO��Pb��PbSO4��)���Ʊ���ϸ��������Ʒ��3PbO��PbSO4��H2O (����)����Ҫ�Ʊ��������£�

��1��������PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪ______________��
��2����Һ1����Һ3����ɫ���������ᾧ�ɵõ��ĸ���ƷΪ_________(д��ѧʽ)��
��3������������ʱ�����е�Ǧ����������Pb(NO3)2��NO�����ӷ���ʽΪ_______����Һ2��������Ҫ�ɷ�Ϊ________(д��ѧʽ)��
��4���������ϳ����εĻ�ѧ����ʽΪ___________��
��5��������ϴ�Ӳ���ʱ����������Ƿ�ϴ����ȫ�ķ�����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25mL18.4mol/LH2SO4��Һ�м���������ͭƬ�����ȣ���ַ�Ӧ����ԭ��H2SO4�����ʵ����� ��
A.��0.23mol
B.����0.23mol
C.0.23mol��0.46mol֮��
D.����0.46mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����֬�����������һ����( )
A.����ˮ����ȡ�����ֲ��������ȡ��
B.���ȵĴ�����Һȥ����Ч������
C.Ӳˮʹ����ȥ��������������Ϊ�����˳�����Ӧ
D.���ȵĴ�����Һ������ֲ���ͺͿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��W����̬�⻯���������ۺ����ᷴӦ�������ӻ�����ɴ˿�֪�� �� 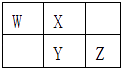
A.X��Y��Z������⻯���ȶ�����������Y
B.ZԪ���������Ӧˮ���������һ��ǿ��Y
C.XԪ���γɵĵ��������ӻ�ԭ�Դ���Y
D.ZԪ�ص����ڻ�ѧ��Ӧ��ֻ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com