
【题目】在pH=12的溶液中能大量共存的离子组是
A.Na+、K+、HSO3-、NO3-
B.Mg2+、ClO-、Na+、Cl-
C.Fe3+、Na+、SCN-、SO42-
D.MnO4-、NO3-、Na+、K+
科目:高中化学 来源: 题型:
【题目】下列对硫酸生产中化学反应原理的分析正确的是 ( )。
A.硫酸生产中涉及的三个化学反应因原料的不同可能全部是非氧化还原反应
B.硫酸生产中涉及的三个化学反应都是放热反应
C.硫酸生产中涉及的三个化学反应都需要使用催化剂
D.硫酸生产中涉及的三个化学反应都需要在较高温度条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的工业制备原理不正确的是( )
A.氨气:N2+3H2![]() 2NH3
2NH3
B.硅:SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.乙烯:2C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.漂白粉:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40 mol的N2O4气体充入2 L已经抽成真空的固定容积的密闭容器中,发生反应N2O4(g)![]() 2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),隔一段时间对该容器内的物质进行分析,得到如下数据:
| 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0. 20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为 ___________mol L-1·s-1
(2)计算在80℃时该反应的平衡常数K =____________(请注明单位)。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变)。
(4)要增大该反应的K值,可采取的措施有_________(填字母代号)
A.增大N2O4起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线_________。
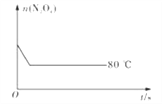
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是




图1 图2 图3 图4
A. 图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B. 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到的滴定曲线
D. 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25mL18.4mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.23mol
B.等于0.23mol
C.0.23mol~0.46mol之间
D.等于0.46mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cu跟浓H2SO4反应,得到SO2的体积为22.4L(标准状况).把所得的CuSO4配制成500mL溶液.求:
(1)反应过程中转移电子的物质的量.
(2)所得溶液中溶质的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3+2HI===2FeCl2+I2+2HCl 2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH===2Fe(OH)3+2KI 3I2+6KOH===5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3===2KSCN+CO2↑+H2O KCN+CO2+H2O===HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4 NaClO4
3NaCl+NaClO4 NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A. 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 B. 还原性(碱性溶液):Fe(OH)2>I2>KIO3
C. 热稳定性:NaCl>NaClO4>NaClO D. 酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
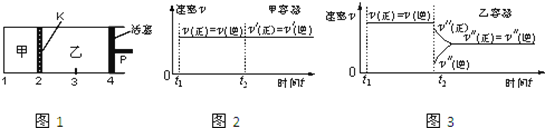
A. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com