
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率一定最低
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】学习了元素周期律的知识后,同学们设计了多个实验探究元素性质的递变规律。
Ⅰ.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,选取C、Si、S三种非金属元素的常见化合物,设计了如图装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
(1)甲组同学设计实验时,A中装H2SO4,则B,C中分别装
B____________________C__________________;
(2)烧杯C中发生反应的离子方程式 ____________________,
(3)通过实验得出的结论:元素非金属性强弱顺序为 ________________。(填元素符号)
Ⅱ.乙组同学认为利用图1装置可直接比较Cl2和S单质的氧化性强弱,他们选择的药品是浓盐酸,KMnO4固体, Na2S溶液。
(4)预计C中观察到的现象是__________________________________________________,
(5)C中反应的离子方程式为_____________________________________________________。
(6)有同学提出该装置存在明显缺陷需加以改进,你认为缺陷是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定的密闭容器内,一定温度下,可逆反应A2(g)+3B2(g)![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成1mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内总压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.聚乙烯是热固性塑料
B.酚醛树脂是热塑性塑料
C.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优良性能,其综合性能超过单一材料
D.锦纶接近火焰时先卷缩,燃烧时有烧焦羽毛的臭味,灰烬为有光泽的硬块,能压成粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是
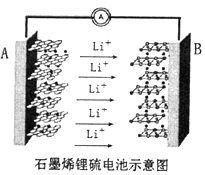
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-=Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 合成纤维和人造纤维可统称为化学纤维
B. 酚醛树脂和聚氯乙烯都是热固性塑料
C. 锦纶丝接近火焰时先蜷缩,灰烬为有光泽的硬块
D. 复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性能超过了单一材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应X(g)+3Y(g)2Z(g)达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比是( )
A.1:3 B.3:1 C.1:2 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
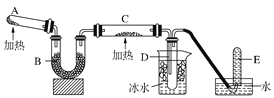
(1)试管A中发生反应的化学方程式是_______________________;
(2)装置B中烧瓶内试剂可选用__(填序号);
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.无水氯化钙
(3)装置C中盛装的物质是___________;实验时在C中观察到的现象是_______;
(4)C中发生的化学反应方程式是________________;
(5)请简述实验室如何验满氨气____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com