
ΓΨΧβΡΩΓΩΦΉΓΔ““ΓΔ±ϊ»ΐ÷÷Μ·ΚœΈοΨυ”…«βΓΔΒΣΓΔ―θΓΔΆ≠ΥΡ÷÷‘ΣΥΊ÷–ΝΫ÷÷‘ΣΥΊΉι≥…ΓΘ≥ΘΈ¬œ¬Θ§ΦΉ «“Μ÷÷Κ§ΒΣ÷ ΝΩΖ÷ ΐΈΣ87.5%ΒΡ“ΚΧ§Μ·ΚœΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ”κΩ’Τχ÷–Ρ≥÷÷÷ς“Σ≥…ΖίΒΡœύΕ‘Ζ÷Ή”÷ ΝΩœύΆ§ΘΜ““ΚΆ±ϊ «Ά≠ΒΡΝΫ÷÷≥ΘΦϊ―θΜ·ΈοΘ§““ «–¬÷ΤΒΡ«β―θΜ·Ά≠”κ““»©Ζ¥”ΠΒΡΜΙ‘≠≤ζΈοΓΘ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΦΉΒΡΫαΙΙ Ϋ___ΓΘ
Θ®2Θ©ΦΉΚΆ±ϊΖ¥”ΠΒΡ≤ζΈο÷–Κ§”–““ΚΆ“Μ÷÷ΤχΧ§ΒΞ÷ Θ§–¥≥ωΤδΜ·―ßΖΫ≥Χ Ϋ___ΓΘ
Θ®3Θ©œρ““ΙΧΧε÷–Φ”»κΙΐΝΩΝρΥαΥαΜ·ΒΡΝρΥαΧζ»ή“ΚΘ§““ΙΧΧεΆξ»Ϊ»ήΫβΘ§ΒΟΒΫΆΗΟς»ή“ΚΓΘ
ΔΌ–¥≥ωΤδάκΉ”ΖΫ≥Χ Ϋ___ΓΘ
ΔΎ»τΥυΒΟ»ή“Κ―τάκΉ”≈®Ε»Ψυ‘ΦΈΣ0.1molL-1Θ§‘ΌœρΥυΒΟΜλΚœ“Κ÷–Φ”±ϊΘ§Ήνœ»ΒΟΒΫ___≥ΝΒμ(≤ΜΆ§≈®Ε»ΒΡΫπ τάκΉ”ΩΣ ΦΚΆΆξ»Ϊ“‘«β―θΜ·Έο≥ΝΒμΒΡpH»γΆΦ)ΓΘ

Δέœρ…œ ωΜλΚœ“ΚΦ”»κ”–ΜζίΆ»ΓΦΝ(RH)ΖΔ…ζΖ¥”ΠΘΚ2RH(”–Μζœύ)+Cu2+(Υ°œύ)R2Cu(”–Μζœύ)+2H+(Υ°œύ)Θ§“―÷ΣΤδΥϋ―τάκΉ””κΗΟ”–ΜζΈο≤ΜΡήΖΔ…ζΖ¥”ΠΘ§“≤≤Μœύ»ήΓΘ ‘…ηΦΤ Β―ι―ι÷Λ”–Μζœύ÷–Κ§”–Ά≠‘ΣΥΊ___ΓΘ
ΓΨ¥πΑΗΓΩ![]() N2H4+4CuO=2Cu2O+N2Γϋ+2H2O Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O Fe(OH)3 »Γ”–Μζ≤ψΘ§Φ”»κ―ΈΥαΜρœΓΝρΥαΘ§’ώΒ¥ΚσΥ°≤ψ≥ άΕ…ΪΘ§‘ρ÷ΛΟς”–Μζœύ÷–Κ§”–Ά≠‘ΣΥΊ
N2H4+4CuO=2Cu2O+N2Γϋ+2H2O Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O Fe(OH)3 »Γ”–Μζ≤ψΘ§Φ”»κ―ΈΥαΜρœΓΝρΥαΘ§’ώΒ¥ΚσΥ°≤ψ≥ άΕ…ΪΘ§‘ρ÷ΛΟς”–Μζœύ÷–Κ§”–Ά≠‘ΣΥΊ
ΓΨΫβΈωΓΩ
≥ΘΈ¬œ¬Θ§ΦΉ «“Μ÷÷Κ§ΒΣ÷ ΝΩΖ÷ ΐΈΣ![]() ΒΡ“ΚΧ§Μ·ΚœΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ”κΩ’Τχ÷–Ρ≥÷÷÷ς“Σ≥…ΖίΒΡœύΕ‘Ζ÷Ή”÷ ΝΩœύΆ§Θ§“ρΈΣΩ’ΤχΒΡ÷ς“Σ≥…Ζ÷ΈΣ―θΤχΚΆΒΣΤχΘ§Υυ“‘ΗΟΜ·ΚœΈοΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ32ΘΜΆ≠ΒΡΝΫ÷÷≥ΘΦϊ―θΜ·Έο «ΘΚCuOΓΔCu2OΘ§““ «–¬÷ΤΒΡ«β―θΜ·Ά≠”κ““»©Ζ¥”ΠΒΡΜΙ‘≠≤ζΈοΘ§‘ρ““ «Cu2OΘ§±ϊ «CuOΘ§ΝρΥαΥαΜ·ΒΡΝρΥαΧζ»ή“Κ”κCu2OΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCu2O+2Fe3++2H+=2Cu2++2Fe2++H2OΘΜάϊ”Ο»ή“ΚKsp≈–Εœ»ή“Κ÷–Β±≈®Ε»Ψυ‘ΦΈΣ0.1molL-1Fe2+ΓΔFe3+ΓΔCu2+ΒΡ»ΐ÷÷άκΉ”Θ§ΡΡ“ΜΗω–η“ΣΒΡ«β―θΗυάκΉ”ΒΡ≈®Ε»‘Ϋ–Γ(pH‘Ϋ–Γ)Θ§ΡΡ“ΜΗωœ»≥ωœ÷≥ΝΒμΓΘ
ΒΡ“ΚΧ§Μ·ΚœΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ”κΩ’Τχ÷–Ρ≥÷÷÷ς“Σ≥…ΖίΒΡœύΕ‘Ζ÷Ή”÷ ΝΩœύΆ§Θ§“ρΈΣΩ’ΤχΒΡ÷ς“Σ≥…Ζ÷ΈΣ―θΤχΚΆΒΣΤχΘ§Υυ“‘ΗΟΜ·ΚœΈοΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ32ΘΜΆ≠ΒΡΝΫ÷÷≥ΘΦϊ―θΜ·Έο «ΘΚCuOΓΔCu2OΘ§““ «–¬÷ΤΒΡ«β―θΜ·Ά≠”κ““»©Ζ¥”ΠΒΡΜΙ‘≠≤ζΈοΘ§‘ρ““ «Cu2OΘ§±ϊ «CuOΘ§ΝρΥαΥαΜ·ΒΡΝρΥαΧζ»ή“Κ”κCu2OΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCu2O+2Fe3++2H+=2Cu2++2Fe2++H2OΘΜάϊ”Ο»ή“ΚKsp≈–Εœ»ή“Κ÷–Β±≈®Ε»Ψυ‘ΦΈΣ0.1molL-1Fe2+ΓΔFe3+ΓΔCu2+ΒΡ»ΐ÷÷άκΉ”Θ§ΡΡ“ΜΗω–η“ΣΒΡ«β―θΗυάκΉ”ΒΡ≈®Ε»‘Ϋ–Γ(pH‘Ϋ–Γ)Θ§ΡΡ“ΜΗωœ»≥ωœ÷≥ΝΒμΓΘ
ΦΉΓΔ““ΓΔ±ϊ»ΐ÷÷Μ·ΚœΈοΨυ”…«βΓΔΒΣΓΔ―θΓΔΆ≠ΥΡ÷÷‘ΣΥΊ÷–ΝΫ÷÷‘ΣΥΊΉι≥…Θ°≥ΘΈ¬œ¬Θ§ΦΉ «“Μ÷÷Κ§ΒΣ÷ ΝΩΖ÷ ΐΈΣ![]() ΒΡ“ΚΧ§Μ·ΚœΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ”κΩ’Τχ÷–Ρ≥÷÷÷ς“Σ≥…ΖίΒΡœύΕ‘Ζ÷Ή”÷ ΝΩœύΆ§Θ§ΕχΩ’ΤχΒΡ÷ς“Σ≥…Ζ÷ΈΣ―θΤχΚΆΒΣΤχΘ§»γΈΣΒΣΤχΘ§‘ρœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ28Θ§ΟΜ”–ΖϊΚœΈο÷ Θ§»γΈΣ―θΤχΘ§‘ρœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ32Θ§‘ρΗΟΜ·ΚœΈοΚ§NΒΡ÷ ΝΩΈΣ
ΒΡ“ΚΧ§Μ·ΚœΈοΘ§œύΕ‘Ζ÷Ή”÷ ΝΩ”κΩ’Τχ÷–Ρ≥÷÷÷ς“Σ≥…ΖίΒΡœύΕ‘Ζ÷Ή”÷ ΝΩœύΆ§Θ§ΕχΩ’ΤχΒΡ÷ς“Σ≥…Ζ÷ΈΣ―θΤχΚΆΒΣΤχΘ§»γΈΣΒΣΤχΘ§‘ρœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ28Θ§ΟΜ”–ΖϊΚœΈο÷ Θ§»γΈΣ―θΤχΘ§‘ρœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ32Θ§‘ρΗΟΜ·ΚœΈοΚ§NΒΡ÷ ΝΩΈΣ![]() Θ§‘ρΦΉΚ§”–NΓΔHΝΫ÷÷‘ΣΥΊΘ§Ζ÷Ή” ΫΈΣ
Θ§‘ρΦΉΚ§”–NΓΔHΝΫ÷÷‘ΣΥΊΘ§Ζ÷Ή” ΫΈΣ![]() Θ§““ΚΆ±ϊ «Ά≠ΒΡΝΫ÷÷≥ΘΦϊ―θΜ·ΈοΘ§““ «–¬÷ΤΒΡ«β―θΜ·Ά≠”κ““»©Ζ¥”ΠΒΡΜΙ‘≠≤ζΈοΘ§‘ρ““ΈΣ
Θ§““ΚΆ±ϊ «Ά≠ΒΡΝΫ÷÷≥ΘΦϊ―θΜ·ΈοΘ§““ «–¬÷ΤΒΡ«β―θΜ·Ά≠”κ““»©Ζ¥”ΠΒΡΜΙ‘≠≤ζΈοΘ§‘ρ““ΈΣ![]() Θ§±ϊΈΣCuOΓΘ
Θ§±ϊΈΣCuOΓΘ
![]() ΦΉΈΣ
ΦΉΈΣ![]() Θ§ΫαΙΙ ΫΈΣ
Θ§ΫαΙΙ ΫΈΣ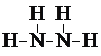 ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ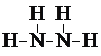 ΘΜ
ΘΜ
![]() ΦΉΚΆ±ϊΖ¥”ΠΒΡ≤ζΈο÷–Κ§”–““ΚΆ“Μ÷÷ΤχΧ§ΒΞ÷ Θ§ΗΟΤχΧεΒΞ÷ ΈΣΒΣΤχΘ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣΘΚ
ΦΉΚΆ±ϊΖ¥”ΠΒΡ≤ζΈο÷–Κ§”–““ΚΆ“Μ÷÷ΤχΧ§ΒΞ÷ Θ§ΗΟΤχΧεΒΞ÷ ΈΣΒΣΤχΘ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
![]() œρ
œρ![]() ΙΧΧε÷–Φ”»κΙΐΝΩΝρΥαΥαΜ·ΒΡΝρΥαΧζ»ή“ΚΘ§
ΙΧΧε÷–Φ”»κΙΐΝΩΝρΥαΥαΜ·ΒΡΝρΥαΧζ»ή“ΚΘ§![]() ΙΧΧεΆξ»Ϊ»ήΫβΘ§ΒΟΒΫΆΗΟς»ή“ΚΘ§”Π…ζ≥…ΝρΥαΆ≠ΚΆΝρΥα―«ΧζΘΚ
ΙΧΧεΆξ»Ϊ»ήΫβΘ§ΒΟΒΫΆΗΟς»ή“ΚΘ§”Π…ζ≥…ΝρΥαΆ≠ΚΆΝρΥα―«ΧζΘΚ
![]() Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ
Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
![]() Ζ¥”ΠΚσΝρΥαΧζΙΐΝΩΘ§”…ΆΦœσΩ…÷Σ
Ζ¥”ΠΚσΝρΥαΧζΙΐΝΩΘ§”…ΆΦœσΩ…÷Σ![]() Άξ»Ϊ≥ΝΒμ ±Υυ–ηpHΫœ–ΓΘ§‘ρΦ”»κCuOœϊΚΡ«βάκΉ” ±Θ§»ή“ΚpH≤ΜΕœ‘ω¥σΘ§ Ήœ»Έω≥ωΒΡ≥ΝΒμ «
Άξ»Ϊ≥ΝΒμ ±Υυ–ηpHΫœ–ΓΘ§‘ρΦ”»κCuOœϊΚΡ«βάκΉ” ±Θ§»ή“ΚpH≤ΜΕœ‘ω¥σΘ§ Ήœ»Έω≥ωΒΡ≥ΝΒμ «![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
![]() ”…Ω…ΡφΖ¥”Π
”…Ω…ΡφΖ¥”Π![]() ”–Μζœύ
”–Μζœύ![]() Υ°œύ
Υ°œύ![]() ”–Μζœύ
”–Μζœύ![]() Υ°œύ
Υ°œύ![]() Ω…÷ΣΘ§Ω…‘Ύ”–Μζœύ÷–Φ”»κ―ΈΥαΜρœΓΝρΥαΘ§‘ρΤΫΚβœρΡφœρ“ΤΕ·Θ§»γ»ή“Κ±δ≥…άΕ…ΪΘ§Ω…ΥΒΟς”–Μζœύ÷–Κ§”–
Ω…÷ΣΘ§Ω…‘Ύ”–Μζœύ÷–Φ”»κ―ΈΥαΜρœΓΝρΥαΘ§‘ρΤΫΚβœρΡφœρ“ΤΕ·Θ§»γ»ή“Κ±δ≥…άΕ…ΪΘ§Ω…ΥΒΟς”–Μζœύ÷–Κ§”–![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ»Γ”–Μζ≤ψΘ§Φ”»κ―ΈΥαΜρœΓΝρΥαΘ§’ώΒ¥ΚσΥ°≤ψ≥ άΕ…ΪΘ§‘ρ÷ΛΟς”–Μζœύ÷–Κ§”–Ά≠‘ΣΥΊΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬Θ§‘Ύ2LΟή±’»ίΤς÷–≥δ»κ4molAΤχΧεΚΆ3molBΤχΧεΘ§ΖΔ…ζœ¬Ν–Ζ¥”ΠΘΚ2A(g)+B(g) ![]() C(g)+xD(g)Θ§5s¥οΒΫΤΫΚβΓΘ¥οΒΫΤΫΚβ ±Θ§…ζ≥…ΝΥ1mol CΘ§≤βΕ®DΒΡ≈®Ε»ΈΣ1mol/LΓΘ
C(g)+xD(g)Θ§5s¥οΒΫΤΫΚβΓΘ¥οΒΫΤΫΚβ ±Θ§…ζ≥…ΝΥ1mol CΘ§≤βΕ®DΒΡ≈®Ε»ΈΣ1mol/LΓΘ
(1)«σx =____ΓΘ
(2)«σ’βΕΈ ±ΦδAΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ_____ΓΘ
(3)ΤΫΚβ ±BΒΡ≈®Ε»ΈΣ______ΓΘ
(4)«σΗΟΈ¬Ε»œ¬Ζ¥”ΠΤΫΚβ≥Θ ΐΈΣ_____________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ2©¹τ«Μυ“λΕΓΥα““θΞΡή»ή”ΎΥ°Θ§ «“Μ÷÷”Π”Ο”Ύ”–ΜζΚœ≥…ΚΆ“©Έο÷Τ‘λΒΡΜ·ΙΛ‘≠ΝœΓΘ

Θ®1Θ©2©¹τ«Μυ“λΕΓΥα““θΞΒΡΖ÷Ή” ΫΈΣ_________Θ§≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«β‘ΎΚΥ¥≈Ι≤’ώ«βΤΉΆΦ÷–”–≤ΜΆ§ΒΡΈϋ ’ΖεΘ§‘ρ2©¹τ«Μυ“λΕΓΥα““θΞ”–_________ΗωΈϋ ’ΖεΘΜ
Θ®2Θ©ΔΌΔΎΒΡΖ¥”Πάύ–ΆΖ÷±πΈΣ_________Θ§_________ΘΜ
Θ®3Θ©“―÷ΣIΈΣδε¥ζΧΰΘ§IΓζBΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________ΘΜ
Θ®4Θ©ΥθΨέ≤ζΈοFΒΡΫαΙΙΦρ ΫΈΣ_________ΘΜ
Θ®5Θ©œ¬Ν–ΙΊ”Ύ![]() ΚΆ
ΚΆ ΒΡΥΒΖ®’ΐ»ΖΒΡ”–_________Θ®ΥΪ―ΓΘ§ΧνΉ÷ΡΗΘ©ΘΜ
ΒΡΥΒΖ®’ΐ»ΖΒΡ”–_________Θ®ΥΪ―ΓΘ§ΧνΉ÷ΡΗΘ©ΘΜ
AΘ°Κσ’Ώ”ωΒΫFeCl3»ή“Κœ‘Ήœ…ΪΘ§Εχ«Α’Ώ≤ΜΩ…
BΘ°ΝΫ’ΏΕΦΩ…“‘”κNaHCO3»ή“ΚΖ¥”ΠΖ≈≥ωCO2
CΘ°ΝΫ’ΏΕΦΩ…“‘”κ«β―θΜ·ΡΤ»ή“ΚΖΔ…ζΖ¥”ΠΘ§Β±ΝΫ’ΏΈο÷ ΒΡΝΩœύΒ» ±Θ§œϊΚΡ«β―θΜ·ΡΤΒΡΝΩ≤ΜœύΒ»
DΘ°ΝΫ’ΏΕΦΩ…“‘”κ«βΤχΖΔ…ζΦ”≥…Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–”–ΙΊ Β―ιΉΑ÷ΟΒΡΥΒΖ®÷–’ΐ»ΖΒΡ «
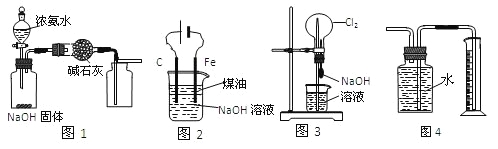
A. ”ΟΆΦ1ΉΑ÷Ο÷Τ»ΓΗ…‘ο¥ΩΨΜΒΡNH3
B. ”ΟΆΦ2ΉΑ÷Ο÷Τ±ΗFe(OH)2≤ΔΡήΫœ≥Λ ±ΦδΙέ≤λΤδ―’…Ϊ
C. ”ΟΆΦ3ΉΑ÷ΟΩ…“‘Άξ≥…ΓΑ≈γ»ΣΓ± Β―ι
D. ”ΟΆΦ4ΉΑ÷Ο≤βΝΩCu”κ≈®œθΥαΖ¥”Π≤ζ…ζΤχΧεΒΡΧεΜΐ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®1Θ©AΓΔBΓΔC «÷–―ßΜ·―ß≥ΘΦϊΒΡ»ΐ÷÷Έο÷ Θ§ΥϋΟ«÷°ΦδΒΡœύΜΞΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΘ®≤ΩΖ÷Ζ¥”ΠΧθΦΰΦΑ≤ζΈο¬‘»ΞΘ©

Θ®1Θ©»τA «“Μ÷÷ΜΤ…ΪΒΞ÷ ΙΧΧεΘ§‘ρBΓζCΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______________ΓΘ≈®ΒΡD»ή“Κ Ι÷Ϋ’≈±δΚΎΧεœ÷ΝΥΥϋΒΡ___________–‘ΓΘ
Θ®2Θ©»τC «ΚλΉΊ…ΪΤχΧεΘ§‘ρAΜ·―ß ΫΩ…Ρή_________ΘΜ–¥≥ωœΓΒΡD»ή“Κ”κΆ≠Ζ¥”ΠΒΡάκ”ΎΖΫ≥Χ Ϋ___________________________________________ΓΘ
Θ®IIΘ©ΙΛ“Β…œ÷ΈΝΕ¬ΝΒΡ‘≠Νœ «¬ΝΆΝΘ®÷ς“Σ≥…Ζ÷ «A12O3Θ§‘”÷ ΈΣFe2O3ΓΔFeOΓΔSiO2Β»Θ©ΓΘΡ≥―–ΨΩ–ΓΉη…ηΦΤΒΡΧα¥ΩA12O3ΒΡΖΫΑΗ»γœ¬

Θ®3Θ©¬Υ“Κ2÷–Κ§”–ΒΡ»ή÷ ”–NaOHΓΔ______ΚΆ______Θ®ΧνΜ·―ß ΫΘ©ΓΘ
Θ®4Θ©Φ”»κΙΐΝΩNaOH»ή“ΚΙΐ¬ΥΚσΘ§»τ¬Υ‘ϋ÷–Fe(OH)2±ΜΩ’Τχ―θΜ·Θ§–¥≥ωΤδ±Μ―θΜ·ΒΡΜ·―ßΖΫ≥Χ Ϋ___________________________ΓΘ
Θ®5Θ©–¥≥ωΆ®»κΙΐΝΩCO2…ζ≥…≥ΝΒμA ±Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”ΟΒΈ”–Ζ”ΧΣΚΆ¬»Μ·ΡΤ»ή“Κ Σ»σΒΡ¬Υ÷ΫΖ÷±πΉωΦΉΓΔ““ΝΫΗω Β―ιΘ§œ¬Ν–≈–Εœ¥μΈσΒΡ «Θ® Θ©
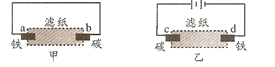
A.bΦΪΗΫΫϋ”–Τχ≈ίΟΑ≥ωB.dΦΪΗΫΫϋ≥ωœ÷Κλ…Ϊ
C.aΓΔcΦΪ…œΕΦΖΔ…ζ―θΜ·Ζ¥”ΠD.ΦΉ÷–ΧζΑτ±»““÷–ΧζΑτΗϋ“ΉΗ· ¥
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥―ß–ΘΜ·―ß–Υ»Λ–ΓΉιΈΣΧΫΥςΫπ τΜΊ ’ΈοΒΡΉέΚœάϊ”ΟΘ§Ή®Ο≈…ηΦΤ Β―ι”ΟΚ§”–¬ΝΓΔΧζΓΔΆ≠ΒΡΚœΫπ÷Τ»Γ¥ΩΨΜΒΡ¬»Μ·¬Ν»ή“ΚΓΔ¬ΧΖ·ΨßΧε(FeSO4ΓΛ7H2O)ΚΆΒ®Ζ·ΨßΧε(CuSO4ΓΛ5H2O)Θ§Τδ Β―ιΖΫΑΗ»γœ¬ΘΚ
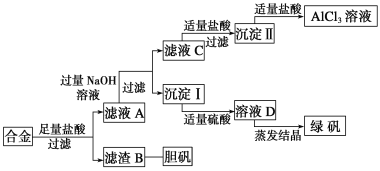
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)Ιΐ¬Υ”ΟΒΡ≤ΘΝß“«Τς”–___________________________________________________ΓΘ
(2)‘Ύ¬Υ“ΚCΉΣΜ·ΈΣ≥ΝΒμΔρΒΡΙΐ≥Χ÷–―ΈΥαΒΡ”ΟΝΩ≤Μ“ΉΩΊ÷ΤΘ§Ω…ΗΡΈΣΆ®CO2ΤχΧεΘ§–¥≥ω¬Υ“ΚC÷–Ά®»κΙΐΝΩCO2ΒΡάκΉ”ΖΫ≥Χ ΫΘΚ______________________________________________ΓΘ
–¥≥ω”…≥ΝΒμΔρΉΣΜ·ΈΣAlCl3»ή“ΚΒΡάκΉ”ΖΫ≥Χ ΫΘΚ_____________________________ΓΘ
(3)–ΓΉι≥…‘±Ψ≠ΙΐΦλ≤βΘ§ΖΔœ÷÷ΤΒΟΒΡ¬ΧΖ·≤Μ¥ΩΘ§ ‘Ζ÷ΈωΤδ÷ς“ΣΚ§”–ΡΡ–©‘”÷ ΘΚ_______________________________Θ§“Σœκ”…≥ΝΒμΔώΉν÷’÷ΤΒΟ¥ΩΕ»ΫœΗΏΒΡ¬ΧΖ·Θ§”Π»γΚΈΗΡΫχ___________________________________
(4)–ΓΉι≥…‘±¥”Ή Νœ÷–Μώ÷ΣH2O2 «“Μ÷÷¬Χ…Ϊ―θΜ·ΦΝΘ§‘Ύ¬Υ‘ϋB÷–Φ”»κœΓΝρΥαΚΆH2O2ά¥÷Τ±ΗΒ®Ζ·ΨßΧεΘ§‘ρΗΟΖ¥”ΠΒΡΉήΜ·―ßΖΫ≥Χ ΫΈΣ_______________________________ΓΘ
(5)”–Ά§―ßΧα≥ωΩ…ΫΪΖΫΑΗ÷–Ήν≥θ»ήΫβΚœΫπΒΡ―ΈΥαΗΡΈΣ…’ΦνΘ§÷Ί–¬…ηΦΤΖΫΑΗΘ§“≤ΡήΉν÷’÷ΤΒΟ»ΐ÷÷Έο÷ Θ§Ρψ»œΈΣΒΎΕΰ÷÷ΖΫΑΗœύΕ‘”ΎΒΎ“Μ÷÷ΖΫΑΗ________(ΧνΓΑΗϋΚœάμΓ±ΜρΓΑ≤ΜΚœάμΓ±)Θ§άμ”… «________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΥ° «ΦΪ»θΒΡΒγΫβ÷ Θ§ΗΡ±δΈ¬Ε»ΜρΦ”»κΡ≥–©ΒγΫβ÷ Μα”ΑœλΥ°ΒΡΒγάκΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)¥ΩΥ°‘Ύ 100Γφ ±Θ§pHΘΫ6Θ§ΗΟΈ¬Ε»œ¬ 0.1molL©¹1 ΒΡ NaOH »ή“Κ÷–Θ§»ή“ΚΒΡ pHΘΫ_____ΓΘ
(2)25Γφ ±Θ§œρΥ°÷–Φ”»κ…ΌΝΩΧΦΥαΡΤΙΧΧεΘ§ΒΟΒΫ pH ΈΣ 11 ΒΡ»ή“ΚΘ§ΤδΥ°ΫβΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____Θ§ ”…Υ°Βγάκ≥ωΒΡ c(OH©¹)ΘΫ_____molL©¹1ΓΘ
(3)ΧεΜΐΨυΈΣ 100mLΓΔpH ΨυΈΣ 2 ΒΡ―ΈΥα”κ“Μ‘ΣΥα HXΘ§Φ”Υ°œΓ ΆΙΐ≥Χ÷– pH ”κ»ή“ΚΧεΜΐΒΡΙΊœΒ»γΆΦΥυ ΨΘ§‘ρ HX «_____(ΧνΓΑ«ΩΥαΓ±ΜρΓΑ»θΥαΓ±)Θ§άμ”… «_____ΓΘ

(4)ΒγάκΤΫΚβ≥Θ ΐ «ΚβΝΩ»θΒγΫβ÷ Βγάκ≥ΧΕ»«Ω»θΒΡΈοάμΝΩΓΘ
Μ·―ß Ϋ | Βγάκ≥Θ ΐ(25Γφ) |
HCN | KΘΫ4.9ΓΝ10©¹10 |
CH3COOH | KΘΫ1.8ΓΝ10©¹5 |
H2CO3 | K1ΘΫ4.3ΓΝ10©¹7ΓΔK2ΘΫ5.6ΓΝ10©¹11 |
ΔΌ25Γφ ±Θ§Β»≈®Ε»ΒΡ NaCN »ή“ΚΓΔNa2CO3 »ή“ΚΚΆ CH3COONa »ή“ΚΘ§pH ”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ________(ΧνΜ·―ß Ϋ)ΓΘ
ΔΎ25Γφ ±Θ§‘Ύ 0.5mol/L ΒΡ¥ΉΥα»ή“Κ÷–”…¥ΉΥαΒγάκ≥ωΒΡ c(H+)‘Φ «”…Υ°Βγάκ≥ωΒΡ c(H+)ΒΡ_________±ΕΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν––π ω’ΐ»ΖΒΡ «( )
A.Κ§![]() ΗωάκΉ”ΒΡΙΧΧε
ΗωάκΉ”ΒΡΙΧΧε![]() »ή”ΎΥ°≈δ≥…1L»ή“ΚΘ§ΥυΒΟ»ή“Κ÷–
»ή”ΎΥ°≈δ≥…1L»ή“ΚΘ§ΥυΒΟ»ή“Κ÷–![]() ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ2
ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ2![]()
B.![]() ‘ΎΩ’Τχ÷–≥ΛΤΎΖ≈÷Ο±δΜκΉ«ΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ
‘ΎΩ’Τχ÷–≥ΛΤΎΖ≈÷Ο±δΜκΉ«ΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]()
C.Ω…“‘”Ο≥Έ«ε ·Μ“Υ°Φχ±π![]() ΚΆ
ΚΆ![]()
D.ΒΈΦ”KSCNœ‘Κλ…ΪΒΡ»ή“Κ÷–¥φ‘ΎΘΚ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com