
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )
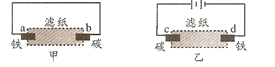
A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
【答案】A
【解析】
甲构成原电池,乙为电解池,甲中铁发生吸氧腐蚀,正极上电极反应式为2H2O+O2+4e-=4OH-,乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极附近有大量OH-,溶液呈碱性,无色酚酞试液遇碱变红色,以此解答该题。
A、b极附是正极,发生电极反应式为2H2O+O2+4e-=4OH-,所以无气泡冒出,故A错误;
B、乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极附近有大量OH-,溶液呈碱性,无色酚酞试液遇碱变红色,故B正确;
C、a是原电池的负极发生氧化反应、c极是电解池的阳极发生氧化反应,所以a、c极上都发生氧化反应,故C正确;
D、甲中铁是原电池的负极被腐蚀,而乙中是电解池的阴极被保护,所以甲中铁棒比乙中铁棒更易腐蚀,故D正确;
故答案选A。


科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
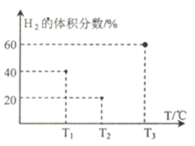
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
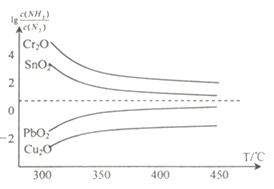
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
)的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
A.①②④B.①②④⑤⑥C.①②④⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中两种元素组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同;乙和丙是铜的两种常见氧化物,乙是新制的氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式___。
(2)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式___。
(3)向乙固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式___。
②若所得溶液阳离子浓度均约为0.1molL-1,再向所得混合液中加丙,最先得到___沉淀(不同浓度的金属离子开始和完全以氢氧化物沉淀的pH如图)。

③向上述混合液加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。试设计实验验证有机相中含有铜元素___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。请完成下列填空:
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是_______。
(2)氧化镁的电子式为_______,CO2的结构式为______。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为______,其1个原子中能量最高的电子有______个。
(3)一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:CO2(g)+Fe(s)![]() FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
(4)下列说法错误的是_______。
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)保持温度不变的情况下,待反应达到平衡后再充入一定量的二氧化碳,平衡向______移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率_____(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是:( )
A.加入合金的质量不可能为6.4g
B.沉淀完全时消耗NaOH溶液的体积为120mL
C.溶解合金时收集到NO气体的体积在标准状况下为2.24L
D.参加反应的硝酸的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向100mL0.1mol/LNH4HSO4溶液中逐滴滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设溶液的体积有加和性)。下列分析正确的是
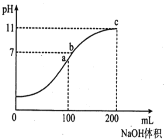
A.ab段和bc段发生的离子反应一定不同
B.水的电离程度最大的是c点
C.b点溶液中各离子浓度由大到小的排列顺序是:C(Na+)>C(NH4+)>C(SO42-)>C(H+)=C(OH-)
D.NH4+的水解平衡常数Kh的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、原理和现象,正确的是![]()
A.称取![]() 时,将10g的砝码放在右盘,并将游码移到
时,将10g的砝码放在右盘,并将游码移到![]() 的位置
的位置
B.做钠与水反应的实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.向试管中加入5mL溴水、2mL苯和![]() 铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
D.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有![]() 饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com