
��13�֣�ʹ������к͵ζ����ⶨ���۰״���������g/100mL����
��ʵ�鲽�裺
��1������100mL����״���Һ����ȡ10.00mLʳ�ð״ף�ע���ձ�����ˮϡ�ͺ�ת�Ƶ�___________�����������ƣ��ж��ݣ�ҡ�ȼ��á�
��2���� ȡ����״���Һ20.00 mL����ƿ�У������еμ�2�� ��ָʾ����
��3����ȡʢװ0.1000 mol/L NaOH ��Һ�� �����������ƣ��ij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ mL��
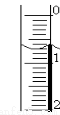
��4���ζ����� ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��ʵ���¼
�ζ����� ʵ�����ݣ�mL�� | 1 | 2 | 3 | 4 |
V(��Ʒ) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)�����ģ� | 15.95 | 15.00 | 15.05 | 14.95 |
�����ݴ��������ۣ�
��1�������㣬���۰״��������� g/100mL��
��2���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ����� ����д��ţ���
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
I����1��100mL����ƿ ��2����ʽ�ζ��ܣ�����Һ�ܣ� ��̪ ��3����ʽ�ζ��� 0.70
��4����Һ����ɫǡ�ñ�Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ III����1��4.5 ��2��a b
��������
���������I����1������100mL��Һ����100mL����ƿ����2��ȡ��Һ20.00 mL��������ʽ�ζ��ܣ�ǿ��ζ����ᣬ�÷�̪��ָʾ������3��NaOH ��Һʢװ�ڼ�ʽ�ζ����У�ͼʾ����Ϊ0.70mL����4���ζ��յ���ж�����Һ����ɫǡ�ñ�Ϊ�ۺ�ɫ���Ұ�����ڲ���ɫ��III����1��ÿ��ƽ��������������15mL������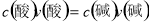 ���ô����Ũ��Ϊmol/L=0.75 mol/L����������g/100mL��=0.75��0.1��60=4.5����2��δ�ñ�NaOH��Һ��ϴ����������Ũ��ƫ�ͣ����������������ƫ�����Խ��ƫ��ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����������������ƫ�����Խ��ƫ����ƿ�м������״���Һ���ټ�����ˮ���������ʵ������䣬������������������䣬�ʽ�����䣻��ƿ�ڵζ�ʱ����ҡ����������Һ�彦�����������ʵ�����С�������������������С���ʽ��ƫ�͡�
���ô����Ũ��Ϊmol/L=0.75 mol/L����������g/100mL��=0.75��0.1��60=4.5����2��δ�ñ�NaOH��Һ��ϴ����������Ũ��ƫ�ͣ����������������ƫ�����Խ��ƫ��ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����������������ƫ�����Խ��ƫ����ƿ�м������״���Һ���ټ�����ˮ���������ʵ������䣬������������������䣬�ʽ�����䣻��ƿ�ڵζ�ʱ����ҡ����������Һ�彦�����������ʵ�����С�������������������С���ʽ��ƫ�͡�
���㣺���⿼���к͵ζ���


 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���У����ܹ۲쵽�����������
A��������ͨ�뵽FeSO4��Һ�� B����һ�δ�ĥ������������������ˮ��
C����Na2CO3��Һͨ��������CO2 D������ˮ�μӵ�KI������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и߶���ѧ����ĩ���Ի�ѧ���Ծ��������棩 ���ͣ�?????
��������ͨ��ˮ�����γɵ���ʵ���
A������ B��N2 C��CH4 D��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и߶���ѧ����ĩ���Ի�ѧ���Ծ��������棩 ���ͣ�?????
���������мȺ��й��ۼ��ֺ������Ӽ�����
A��HF B��NaCl C��HCl D��K2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и߶���ѧ����ĩ���Ի�ѧ���Ծ��������棩 ���ͣ�?????
���� ��������ȷ����
��������ȷ����
A���˵����Ϊ34 B��������Ϊ16
C�����������Ϊ18 D��ԭ������Ϊ16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и߶���ѧ����ĩ���Ի�ѧ���Ծ��������棩 ���ͣ�ѡ����
����0.1molL-1 (NH4)2SO4��Һ������ȷ����
A��c(NH4��)> c(SO42�D) B��c(NH4��)+ c(NH3H2O)= 2c(SO42�D)
C��c(NH4��)+c(H��)= c(SO42�D)+ c(OH�D) D����������NaOH���壬c(NH4��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и߶���ѧ����ĩ���Ի�ѧ���Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A������ͭʱ��ͭ����������ͭ������
B�����MgCl2������Һ�����Ƶý���þ
C�������ĸ�ʴͨ��Ϊ�绯ѧ��ʴ���ø�ʴ�����и�����ӦΪ��Fe�C3e��=== Fe 3+
D���ȼҵ�ͽ����Ƶ�ұ�����õ���NaCl��������Ӧ���ǣ�2C1һ�C2e�� === C12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����ж�������һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��6�֣�ʵ������Ҫ65 mL 1.0 mol/L��NaCl��Һ���ڲⶨAgNO3��Һ��Ũ�ȡ�
��1����NaCl��������NaCl��Һʱ�����õ���������__________������ţ���
����ƽ ���ձ� �۲����� �ܾƾ��� �ݽ�ͷ�ι� ��50 mL����ƿ ��100 mL����ƿ
��2����Ҫ��ȡNaCl�����������__________��
��3����ȡ20 mL AgNO3��Һ��������25 mL 1.0 mol/L NaCl��Һʱǡ����ȫ��Ӧ����c��AgNO3����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�߶�12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ����һ��Ũ�ȵ������һ��Ũ�ȵİ�ˮ��2��1 ������Ȼ�ϣ��������Һ��c(NH4+)��c(Cl��)������Һ��pH
A������7 B��С��7 C������7 D����ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com