
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H3(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时, 移向电池的_______(填“正”或“负”)极。
移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3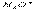
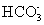 +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c( )(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
【答案】
(1)124.2
(2)C3H8+5O2 3CO2+4H2O 负
3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> 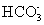 +H2O
+H2O
 +
+ (或
(或 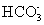

 +H+)
+H+)
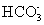 +H2O
+H2O H2CO3 +OH- 、
H2CO3 +OH- 、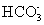 的水解程度大于电离程度
的水解程度大于电离程度
【解析】(1)①-②得C3H8(g) CH3CH=CH2(g)+H2(g) ΔH=ΔH1-ΔH2=124.2 kJ·mol-1。
CH3CH=CH2(g)+H2(g) ΔH=ΔH1-ΔH2=124.2 kJ·mol-1。
(2)该电池中,O2在正极得电子,与CO2结合成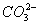 ,生成的
,生成的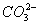 向负极移动。
向负极移动。
(3)K1=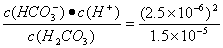 =4.2×10-7 mol·L-1。
=4.2×10-7 mol·L-1。
(4)pH>8,溶液显碱性,则说明水解程度大于电离程度,水解: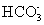 +H2O
+H2O H2CO3 +OH-,电离:
H2CO3 +OH-,电离: +H2O
+H2O
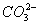 +H3O+,所以c(H2CO3)>c(
+H3O+,所以c(H2CO3)>c(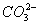 )。
)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铁和水蒸气在高温条件下发生反应3Fe+4H2O(g)  Fe3O4+4H2 ,在此反应中水是( )
Fe3O4+4H2 ,在此反应中水是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质。Z为品红溶液。实验中观察到Z褪色。则Y为
A.Na B.Mg C.Al D.Mg或Al
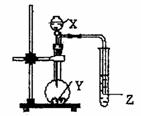
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)  2HCl(g)+Q1
2HCl(g)+Q1
H2(g)+Br2(g)  2HBr(g)+Q2
2HBr(g)+Q2
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g) 2HF(g)+270 kJ,下列说法正确的是( )
2HF(g)+270 kJ,下列说法正确的是( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热(kJ·mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
*燃烧热:1摩尔物质完全燃烧,生成二氧化碳、液态水时所放出的热量
根据表中数据,下列判断错误的是( )。
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2 (SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液2 5.00 mL。
5.00 mL。
已知:
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序不正确的是( )
A.熔点:CF4 < CCl4 B.熔点: K > Na
C.硬度: 金刚石 > 碳化硅 D.晶格能: Na > NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验不能达到预期实验目的的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 将2.5gCuSO4·5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com