
【题目】某温度下,向一定体积0.1 mol·L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示。 下列说法错误的是

A. 此温度下,水的离子积常数为1.0×10-2a
B. M、N两点所示的溶液中,水的电离程度相同
C. Q点消耗的NaOH溶液的体积等于HA溶液的体积
D. N点溶液加水稀释,![]() 减小
减小
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定实验类似,现用0.1000mol/L的酸性高锰酸钾溶液滴定未
知浓度的无色亚硫酸氢钠溶液,回答下列问题:
(1)滴定前润洗滴定管的操作方法__________。
(2)某同学测得的实验数据如下表
1 | 2 | 3 | 4 | |
亚硫酸氢钠溶液体积mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初体积mL | 0.00 | 1.02 | 1.00 | 0.80 |
滴定管末体积mL | 40.02 | 41.00 | 41.00 | 42.90 |
求待测液亚硫酸氢钠的物质的量浓度________。
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,则计算值比实际值___(填“偏高”或“偏低”或“不变”) 。
(4)常温下0.1000mol/L亚硫酸溶液中H2SO3 HSO3- SO32-三者所占物质的量分数(a)随pH变化的关系如图所示,已知lg2=0.3,则原亚硫酸氢钠溶液的pH=_______:
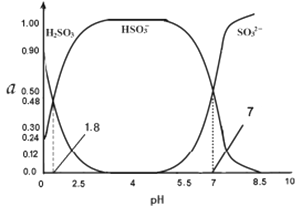
(5)取上述亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,(假定加固体后溶液的体积不变),则该溶液能溶解硫酸钡的物质的量n=______(已知该温度时KSp(BaSO4)=1.0×10-10 KSp(BaSO3)=1.0×10-8 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
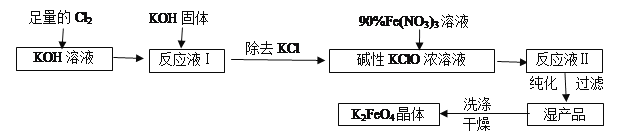
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________。
(2)在溶液Ⅰ中加入KOH固体的目的是________(填编号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为________mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ OH-。___________
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________。
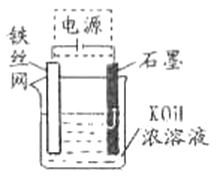
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。
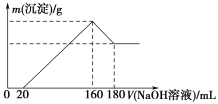
(1)加入NaOH溶液0~20 mL时的反应的离子方程式为________________,160~180 mL时的反应的离子方程式为____________________________。
(2)合金中Mg的质量为________g,所用HCl的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
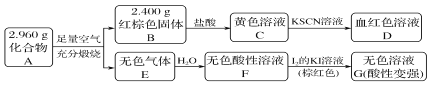
请回答:
(1)A的组成元素为________(用元素符号表示),化学式为_____________________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式____________________。
写出F→G反应的化学方程式___________________________________。
设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
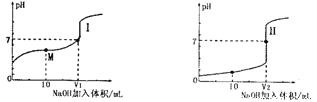
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如下图,填写图中的空白。
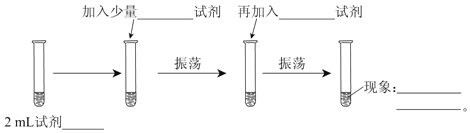
(1)2 mL试剂_______________;
(2)加入少量___________试剂;
(3)再加入___________试剂;
(4)现象_____________________________________________________。
(5)可以证明Cl2的氧化性____________(填强于、弱于)Br2的氧化性。
(6)发生反应的离子反应方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com