
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:

已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95 ℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)实验室干燥气体B的方法是___________________。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②________________________。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为______________。
(3)工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2原理如下:

电解池中两个电极的产物分别是NCl3和H2,写出电解池总反应的离子方程式为_____________________________。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置 30 min;
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
①上述步骤3中滴定终点的现象是______________________;
②根据上述步骤可计算出原ClO2溶液的浓度为___________g/L(用含字母的代数式表示)。
【答案】 通过装有碱石灰的干燥管 控制好反应温度 NCl3+6ClO![]() +3H2O===6ClO2↑+NH3↑+3Cl-+3OH- NH4++2H++3Cl-
+3H2O===6ClO2↑+NH3↑+3Cl-+3OH- NH4++2H++3Cl-![]() NCl3+3H2 最后一滴滴入后,溶液从蓝色变成无色,且30 s内不变色 135cV2/V1
NCl3+3H2 最后一滴滴入后,溶液从蓝色变成无色,且30 s内不变色 135cV2/V1
【解析】NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3;
(1)氨气是碱性气体,可以通过装有碱石灰的干燥管干燥氨气;由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH,反应的离子方程式为NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-;(3)电解池中两个电极的产物分别是NCl3和H2,反应物是盐酸和氯化铵,因此电解池总反应的离子方程式为NH4++2H++3Cl-![]() NCl3+3H2↑。(4) 设原ClO2溶液的浓度为x,准确量取ClO2溶液10.00mL,稀释成100.00mL试样,则浓度变为:x/10,根据方程式可知
NCl3+3H2↑。(4) 设原ClO2溶液的浓度为x,准确量取ClO2溶液10.00mL,稀释成100.00mL试样,则浓度变为:x/10,根据方程式可知
2ClO2~5I2~10Na2S2O3
2mol 10mol
x/10×V1×10-3mol 1×10-3cV2mol
x=2cV2/V1mol/L=67.5g/mol×2cV2/V1mol/L=135cV2/V1gL-1。


科目:高中化学 来源: 题型:
【题目】有下列四种微粒:① ![]() O、②
O、② ![]() Mg、③2311Na、④
Mg、③2311Na、④ ![]() N,
N,
(1)按原子半径由大到小顺序排列的是(用序号填空,下同)
(2)微粒中质子数小于中子数的是
(3)在化合物中呈现的化合价的数值最多的是
(4)能形成X3Y2型化合物的是;
写出形成X2Y2型化合物的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种常见烃的含氧衍生物分子的比例模型.关于该物质的说法正确的是( ) 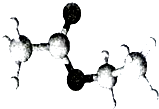
A.无色无味、易溶子水的液体
B.具有酸性,能使石蕊试液变红
C.含有羟基,能与金属Na反应
D.含有酯基,能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为
A. 0.1 mol B. 0.15 mol C. 0.25 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W四种原子序数依次增大的短周期主族元素,X原子的质子数是内层电子数的4倍,Y原子半径是短周期主族元素中最大的,X原子与W原子电子总数是Z原子电子数的2倍,W与X同主族.下列说法正确的是( )
A.X,W的最外层电子数均为6
B.最高价氧化物的水化物的碱性:Y>Z
C.简单气态氢化物的稳定性:W>X
D.Y的单质在X的单质中燃烧生成Y2X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列自发反应不可用熵判据来解释的是
A.CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H20(1)
B.NH4Cl(s)=NH3(g)+HCl(g)
C.2H2(g)+O2(g)=2H2O(l)
D.2C(s)+O2(g)=2CO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个小烧杯里,加入20g Ba(OH)28H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10g NH4C晶体,并用玻璃棒迅速搅拌.
(1)实验中玻璃棒的作用是
(2)写出该反应的化学方程式
(3)通过现象,说明该反应为反应.(填“吸热”或“放热”)这是由于反应物的总能量(填“小于”“大于”或“等于”)生成物的总能量.
(4)某同学将实验做了如图之改进,使用浸有稀硫酸的棉花的目的是 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com