
| A、Y的简单离子半径小于Z的简单离子半径 |
| B、Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
| C、Y的简单气态氢化物在一定条件下可被Q单质氧化 |
| D、Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |


科目:高中化学 来源: 题型:
| A、微粒半径:Fe(OH)3胶粒<K+<S2- |
| B、热稳定性:PH3<NH3<H2O |
| C、碱性:Mg(OH)2<Al(OH)3<NaOH |
| D、熔点:CaCl2<SO3<SiC |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式
某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
| △ |
| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
A、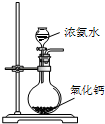 制备少量氨气 |
B、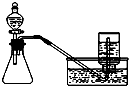 用铜和浓硝酸制取少量NO2 |
C、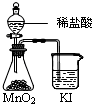 比较MnO2、Cl2、I2的氧化性 |
D、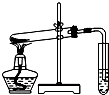 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(H2SO4)=0.6mol c(H2SO4)>6mol/L |
| B、n(H2SO4)=0.3mol c(H2SO4)≥3mol/L |
| C、n(H2SO4)<0.3mol c(H2SO4)<3mol/L |
| D、0.3mol≤n(H2SO4)≤0.6mol 3mol/L≤c(H2SO4)≤6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数:W>Z>X>Y |
| B、离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
| C、Y的气态氢化物比X的气态氢化物稳定 |
| D、氢氧化物碱性强弱:W(OH)2>ZOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com