
【题目】下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是( )
A.氢氟酸
B.硫酸
C.碳酸钠溶液(具有碱性)
D.氢氧化钠溶液
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.活化分子间的碰撞一定发生化学反应
B.吸热反应只有加热才能发生
C.有能量变化的一定是化学反应
D.有化学键断裂不一定发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标1】乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应 ① 2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应 ② 2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应 ③ CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
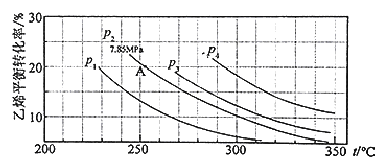
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为乙二酸。

试回答下列问题:
(1)C的结构简式是______________。
B→C的反应类型是________________,
E→F的化学方程式是___________________。
(2)E与乙二酸发生酯化反应生成环状化合物的化学方程式是__________________。
(3)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素①﹣⑩在表中的位置回答下列问题.
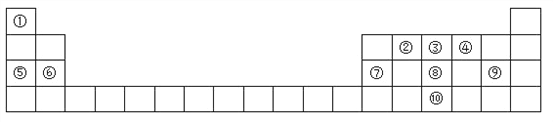
(1)画出⑩的原子结构示意图:______
(2)③、④、⑧的气态氢化物稳定性由小到大的顺序是:______(填化学式)
(3)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是:______(填化学式)
(4)②、④两元素形成的AB2型物质的电子式是:______
(5)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:______
(6)写出⑦的单质与⑤的最高价氧化物对应水化物反应的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是
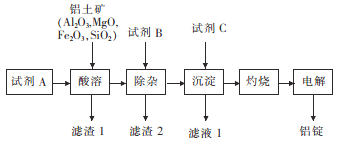
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 电解氧化铝时在阴极上定期补炭块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问題:
(1)乙二醇与灼热的氧化铜反应的方程式:__________________________________。
(2)葡萄糖可以和醋酸在一定条件下发生酯化反应,则1摩尔葡萄糖最多可以消耗________摩尔醋酸。
(3)已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中含有_______和_________两种官能团(写名称)(此空各1分) ;
②乳酸与足量金属钠反应的化学方程式为______________________________________;
③已知两分子乳酸可在一定条件下反应生成环状的酯,写出该反应的方程式__________________。
(4)分子式为C6H12的某烃,其所有的碳原子都一定在同一平面上,则该烃的结构筒式为___________。
(5)某苯的同系物分子式为C11H16,苯环上只有一个取代基,其同分异构体共有_________种。
(6)分子中含有25个共价键的烷烃的分子式为_________,其同分异构休中沸点最低的系统名称是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法中正确的是( )
A.122.5 g KClO3中含Cl-数目为NA
B.1 mol·L-l的NaOH溶液中含Na+数目为NA
C.标准状况下,22.4L水中含氢原子数目为2NA
D。常温常压下,32 g SO3中含氧原子数目为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
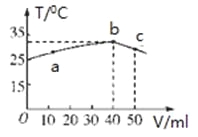
A. HA溶液的物质的量浓度为0.0l mol·L—1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离平衡常数K约为1.43×10—2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com