
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) ![]() H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 ![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将_______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
时间/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2___T1。
【答案】 向左 不改变 -77.6 不变 2.96×10-3mol/(L·s) <
【解析】(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;催化剂对反应热不影响;(2)根据盖斯定律计算;(3)①一定温度下在恒容密闭容器中通入惰气总压增大分压不变,平衡不动;②依据化学反应速率是利用单位时间物质浓度变化计算得到;③根据温度对化学平衡的影响分析判断。
(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;加入催化剂,只改变反应的活化能,但反应热不变,故答案为:向左;不改变;
(2)①O2(g)=O2+(g)+e-△H1=+1175.7kJmol-1,②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJmol-1,③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJmol-1,根据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJmol-1,故答案为:-77.6;
(3)①一定温度下在恒容密闭容器中通入氦气,总压增大,分压不变,平衡不移动,则N2O5的转化率不变,故答案为:不变;
②500s内N2O5的分解速率=![]() =2.96×10-3mol/(Ls),故答案为:2.96×10-3mol/(Ls);
=2.96×10-3mol/(Ls),故答案为:2.96×10-3mol/(Ls);
③2N2O5(g)4NO2(g)+O2(g);△H>0,反应是吸热反应,反应的N2O5浓度变化=5.00-2.48=2.52mol/L,二氧化氮浓度为5.04mol/L,在T2温度下,反应1000s时测得NO2的浓度为4.98molL-1,二氧化氮浓度减小,平衡逆向进行,说明温度降低,T2<T1,故答案为:<。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。

下列关于实验现象的解释或结论正确的是
选项 | 实验现象 | 解释或结论 |
A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32和S2两种离子一定不能大量共存 |
C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32 == BaSO3↓,使SO32水解平衡逆向移动,红色褪去 |
D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4LCCl4含有NA个分子
B.0.1mol/L的HNO3中有0.1NA个H+
C.常温常压下,8gO2含有4NA个电子
D.1molNa被完全氧化生成Na+ , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 往氢氟酸溶液中加水稀释时,c(F-)/c(H+) 增大
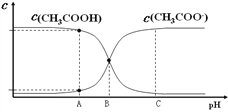
B. 25℃时,0.010 0 mol·L-1 CH3COOH 溶液中,调节溶液pH(忽略体积变化),得到c(CH3COOH) 和 c(CH3COO-)与溶液pH的变化关系如右图所示,A、B、C三点中B对应的溶液抗外界酸、碱的能力最强
C. 将同浓度的Na2CO3、NaHCO3溶液混合后其溶液一定存在2c(H+)+3c(H2CO3)+c(HCO3-)=c(CO32-)+2c(OH-)
D. 已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为 5.6×10-5 mol·L-1,则生成沉淀所需Na2CO3溶液的最小浓度为 5×10-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)硅的最高价氧化物对应水化物化学式可能是_____。
A.H4SiO3 B.H2SiO3 C.H3SiO4 D.HSiO4
(2)金刚石与金刚砂(SiC)具有相似的晶体结构,在金刚砂的空间网状结构中,碳原子、硅原子交替以共价 单键相结合。金刚砂属于_____晶体。金刚砂的熔点比金刚石的熔点_____;金刚砂的结构中,一个硅原子周围结合_____个碳原子。
(3)晶体硅的微观结构与金刚石相似,晶体硅中 Si—Si 键之间的夹角大小约为_____。 下表列有三种物质(晶体)的熔点:
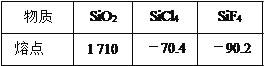
简要解释熔点产生差异的原因:
①SiO2 和 SiCl4:_________________________;
②SiCl4和 SiF4:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(![]() )(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
)(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
沸点(°C,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
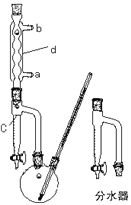
其制备原理如下 :
制备过程:
Ⅰ、制备粗产品:如右图所示的装置中,于50mL圆底烧瓶中加入8.0g苯甲酸(固体)(Mr=122)、20mL乙醇(Mr=46)、15mL环己烷、3mL浓硫酸,摇匀,加沸石。在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
Ⅱ、粗产品的纯化:加水30mL,分批加入固体NaHCO3。分液,水层用20mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210-213℃馏分。
(1) 仪器d的名称__________________,水流方向为____进____出。
(2) 该反应水浴控制的温度为____________。
(3) 该反应加过量乙醇的目的为________________________________。
(4) 分水器的作用____________________,分水器的检漏方法_____________。如何利用实验现象判断反应已基本完成_______________。
(5) 固体碳酸氢钠的作用______________________,加至___________________为止。
(6) 经精馏得210-213℃馏分7.0mL,则该反应的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com