
【题目】苯甲酸乙酯(![]() )(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
)(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
沸点(°C,1atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
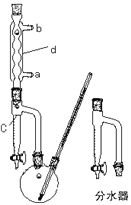
其制备原理如下 :
制备过程:
Ⅰ、制备粗产品:如右图所示的装置中,于50mL圆底烧瓶中加入8.0g苯甲酸(固体)(Mr=122)、20mL乙醇(Mr=46)、15mL环己烷、3mL浓硫酸,摇匀,加沸石。在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
Ⅱ、粗产品的纯化:加水30mL,分批加入固体NaHCO3。分液,水层用20mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210-213℃馏分。
(1) 仪器d的名称__________________,水流方向为____进____出。
(2) 该反应水浴控制的温度为____________。
(3) 该反应加过量乙醇的目的为________________________________。
(4) 分水器的作用____________________,分水器的检漏方法_____________。如何利用实验现象判断反应已基本完成_______________。
(5) 固体碳酸氢钠的作用______________________,加至___________________为止。
(6) 经精馏得210-213℃馏分7.0mL,则该反应的产率为___________。
【答案】 冷凝管、水冷凝管或球形冷凝管 a b 略高于62.6℃ 乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇 分离产生的水,使平衡向正反应方向移动,提高转化率 关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水 加热回流至分水器中水位不再上升为止 中和硫酸和未反应的苯甲酸 不再有气泡产生或pH=7 74.7%
【解析】(1)仪器d的名称为冷凝管、水冷凝管或球形冷凝管,为防止高温气体急剧冷却而炸裂冷凝管,则离蒸气温度高的是出水口,离蒸气温度低的是进水口,所以水流方向为a进b出;(2)根据实验目的知,水浴温度应该略高于62.6℃;(3)增大某一廉价反应物的浓度能提高另一反应物的转化率,且恒沸物也需要乙醇,所以加过量乙醇,故答案为:乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇;(4)分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率;分水器的检漏方法为:关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水;当该反应完成后,就不再生成水,则加热回流至分水器中水位不再上升;(5)碳酸氢钠具有碱性,能和硫酸和苯甲酸反应生成盐,所以加入碳酸氢钠的目的是中和硫酸和未反应的苯甲酸,当反应器中不再有气泡产生或溶液呈中性时,则酸被完全中和,故答案为:中和硫酸和未反应的苯甲酸;不再有气泡产生或pH=7;(6)8.0g苯甲酸(固体)和乙醇反应生成苯甲酸乙酯的质量=![]() ×150g/mol=9.84g,实际上苯甲酸乙酯的质量=1.05g·cm-3×7.0mL=7.35g,则该反应的产率为=
×150g/mol=9.84g,实际上苯甲酸乙酯的质量=1.05g·cm-3×7.0mL=7.35g,则该反应的产率为=![]() ×100%=74.7%。
×100%=74.7%。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出下图所示的曲线。下列有关说法中不正确的是

A. 在0-t1、t1-t2、t2-t3中,t1-t2生成的CO2气体最多
B. 因反应放热,导致0-t1内的反应速率逐渐增大
C. t2-t3的速率V(CO2)= ![]() mL/s
mL/s
D. 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取少量溴苯,试填写下列空白。

(1)请写出仪器名称,a__________、 d __________,在烧瓶a中装的试是__________、__________、_________。
(2)请你推测长直导管b的作用:一是_____________________________,二是____________________________________的作用。
(3)请你分析导管c的下口可否浸没于液面中?为什么?____________________________________
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有________生成,此现象说明这种获得溴苯的反应属于:____________________。(填有机反应类型)
(5)课本采用如下装置进行实验,请在图中标出冷凝水流动方向______(上或下)口进________(上或下)口出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) ![]() H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 ![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将_______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
时间/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2___T1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.10mol/L HA(Ka=10-9.89)溶液,调节溶液pH后。保持[HA] + [A-]=0.10mol/L。下列关系正确的是
A. pH=2.00时,[HA] > [H+]> [OH-] > [A-]
B. pH=7.00时,[HA] = [A-] > [OH-]= [H+]
C. pH=9.89时,[HA] = [A-] > [OH-]> [H+]
D. pH=14.00时,[OH-]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: ![]() ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是

A. 相同条件下,正反应速率: v(A) >v(B)
B. 若在恒容条件下加入稀释剂(N2),能增大乙苯的转化率
C. 若A点乙苯的转化率为60%,则混合气体中苯乙烯的37.5 %
D. 用平衡分压来代替平衡浓度计算,其中分压=总压×物质的量分数,则600℃时,B点的平衡常数Kp=0.019MPa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com