
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�ϲ��ð��Ĵ��������Ʊ����ᡣ
(1) ��֪��ӦN2(g)+3H2(g) 2NH3(g)Ϊ���ȷ�Ӧ���ں�����������˵���÷�Ӧ�ﵽƽ��״̬������_______��
A.������N2��H2��NH3��Ũ��֮��Ϊ1:2:3
B. v��(N2)=v��(H2)
C.������ѹǿ���ֲ���
D.���������ܶȱ��ֲ���
(2)������,Ϊ������ƽ��ʱ��ת����,�ɲ�ȡ�Ĵ�ʩ��_____________(Ҫ��������)
�Ǻϳɰ������Ĵ����������˹��̵�����Ҫ;��,�ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���±�����400��ʱ,���ijʱ�̵��������������������ʵ���Ũ�ȷֱ�Ϊ1 mol��L-1��2 mol��L-1��3 mol��L-1ʱ,��ʱ�̸÷�Ӧ����Ӧ����_____ �淴Ӧ����(����ڡ�����С�ڡ����ڡ���
�¶�/�� | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
(4)�������Ṥ��β����һ�ַ������ü������ԭ���������֪��
�� CH4 (g)��2O2(g)��CO2(g)��2H2O(g) �� H����890.3 kJ��mol-1
�� N2(g)��2O2(g)��2NO2(g) �� H����67.0 kJ��mol-1
��CH4(g)��NO2(g)��ԭΪN2(g)�ȵ��Ȼ�ѧ����ʽΪ___________________________________________
(5)��25 ���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������____����(�ѧʽ)�������ֳ�������ʱ,��Һ��C(Mg2+)/C(Cu2+)=_________(��֪25 ��ʱKsp[Mg(OH)2]=1.8��10-11��Ksp[Cu(OH)2]=2.2��10-20)
���𰸡� C ���¡���ѹ�����백�� С�� CH4(g)+2NO2(g) 2N2 (g) +CO2(g)+ 2H2O(g) ��H=-823.3kJ/mol Cu(OH)2 8.2��108 ��9��109 / 11
����������1�����淴Ӧ�ﵽƽ��ʱ, v��=v�� (ͬ�����ʱ�ʾ)����������֮�ȵ��ڻ�ѧ������֮��(��ͬ���ʱ�ʾ),��Ӧ��������ֵ����ʵ�����Ũ�ȡ��������ٱ仯,�Լ��ɴ�������һЩ��Ҳ�������仯,�ɴ˽����ж�����2�����ݷ�Ӧ�ص��������ƽ��ת���ʵĴ�ʩ����3������Ũ���̺�ƽ�ⳣ����Դ�С�ж�ƽ���ƶ����Ӷ��ƶ����淴Ӧ���ʴ�С����4�����ݸ�˹���ɼ��㷴Ӧ�ȣ���д�Ȼ�ѧ����ʽ����5�������ܶȻ����㡣
���: ��1��A. ������N2��H2��NH3��Ũ��֮��Ϊ1:2:3������˵����Ӧ��������ֵ�Ũ�Ȳ��ٱ仯,����Aѡ���Ǵ������B.���ﵽƽ��״̬ʱ, 3v��(N2)=v��(H2),��B������
C.��Ӧǰ�������������ͬ��ѹǿ����˵����Ӧ�ﵽƽ��״̬,��C��ȷ��D.������������������,�����ݻ�Ϊ��ֵ,�����ܶ���ʼ���ղ���,����˵���ﵽƽ��,��D����������Cѡ������ȷ����
��2�����ڸ÷�ӦΪ���������С�ķ��ȷ�Ӧ������ͨ�����¡���ѹ�����백���ȴ�ʩ����ƽ��ʱ��ת���ʣ���˱����Ϊ�����¡���ѹ�����백����
(3)QC=![]() =2.25>K=0.5��˵����Ӧ���淴Ӧ������������v��(N2)=v��(N2)����ˣ�������ȷ����: С�ڣ�
=2.25>K=0.5��˵����Ӧ���淴Ӧ������������v��(N2)=v��(N2)����ˣ�������ȷ����: С�ڣ�
��4���� CH4 (g)��2O2(g)��CO2(g)��2H2O(g) �� H����890.3 kJ��mol-1
�� N2(g)��2O2(g)��2NO2(g) �� H����67.0 kJ��mol-1
���ݸ�˹��������-�ڵã�CH4(g)+2NO2(g) 2N2 (g) +CO2(g)+ 2H2O(g) ��H=-823.3kJ/mol��
��ˣ�������ȷ����: CH4(g)+2NO2(g) 2N2 (g)+CO2(g)+ 2H2O(g) ��H=-823.3kJ/mol��
��5������Ksp[Cu(OH)2]<Ksp[Mg(OH)2]������������Cu(OH)2�����������ֳ�������ʱ����Һ��Cu(OH)2��Mg(OH)2�ı�����Һ����Һ��OH-����Ũ����ͬ�������ܶȻ��������㣬��Һ��C(Mg2+)/C(Cu2+)=![]() =
=![]() =8.2��108��
=8.2��108��
�ʴ�Ϊ��8.2��108 ��9��109 / 11��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO��SO2�Ǵ�����Ⱦ�ﵫ��������Ҫ��;��
I����֪��N2 (g) + O2(g) �� 2NO (g) ��H1= 180.5kJ��mol1
C(s) + O2(g) �� CO2(g) ��H2 = 393.5kJ��mol1
2C(s) + O2(g) ��2CO(g) ��H3 =221.0kJ��mol1
��1��ij��Ӧ��ƽ�ⳣ������ʽΪK=![]() , �˷�Ӧ���Ȼ�ѧ����ʽΪ��_________
, �˷�Ӧ���Ȼ�ѧ����ʽΪ��_________
��2������Ⱥ����ܱ������г��������NO��CO���з�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����_______������ţ���
a�������е�ѹǿ���� b��2v��(CO)=v��(N2)
c�������ƽ����Է�����������34.2���� d���÷�Ӧƽ�ⳣ�����ֲ���
e��NO��CO������ȱ��ֲ���
II����3��SO2��������Na2S2O3��Ϊ̽��ijŨ�ȵ�Na2S2O3�Ļ�ѧ���ʣ�ijͬѧ�������ʵ�����̣�

�����ӷ���ʽ��ʾNa2S2O3��Һ���м��Ե�ԭ��___________��Na2S2O3����ˮ��Ӧ�����ӷ���ʽ��__________��
��4����SO2����������Na2SO3��Һ���ա��ɽ�����Һ��������������ѭ��ʹ�á�����������ͼ��ʾ��a�缫�Ϻ������ŵ�ķ�ӦʽΪ_________________________����дһ���������ӽ���Ĥ______�����ţ�Ϊ�����ӽ���Ĥ��

��5��2SO3(g)![]() 2SO2(g)+O2(g)����һ������SO3������ݵ��ܱ������У������ƽ��ת�������¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶��£���֪SO3����ʼѹǿΪP0,���¶��·�Ӧ��ƽ�ⳣ��Kp= _______����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ������������ڸ��¶��´ﵽƽ�⣬���������м�������ʵ���SO2��SO3,ƽ�⽫___________���������Ӧ�������淴Ӧ���� �������� �ƶ���
2SO2(g)+O2(g)����һ������SO3������ݵ��ܱ������У������ƽ��ת�������¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶��£���֪SO3����ʼѹǿΪP0,���¶��·�Ӧ��ƽ�ⳣ��Kp= _______����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ������������ڸ��¶��´ﵽƽ�⣬���������м�������ʵ���SO2��SO3,ƽ�⽫___________���������Ӧ�������淴Ӧ���� �������� �ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ���������F��һ�ֺ��ɫ�������Ը���ͼ��ת����ϵ���ش��������⡣

��1��д��A��C��F��G�Ļ�ѧʽ��A________��C________��F________��G________��
��2������C��ҺʱҪ�ӹ���A��ԭ����______________________��
��3��д������ת�������ӷ���ʽ��
��D��C��___________________________________________________��
��C��D��___________________________________________________��
��B��C��D__________________________________________________��
��4��д��E��F�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ָ������ͼʵ��װ���еĴ���֮����(����װ�����ձ��ײ��ѵ���ʯ����)

��_____________________________________����_______________________________________��
��2����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a���������������� b���ò�������©������������Լӿ�����ٶ�
c������ֽʪ��ʹ�����©���� d����ֽ��Ե�߳�©��
��.��������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI=2KCl+I2����ش��������⣺

��1��ָ����ȡ��Ĺ������й�ʵ������ٺ͢۵����ƣ�__________��________��
��2����3 mL��ˮ�У�����1mL���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________(ע���Թ�����ɫ��Ϊ��ɫ��Һ)���²�_____ɫ��

��ij��Һ�к���MgSO4��Na2SO4�������ʣ�ѡ���ʵ��Լ�����Һ�е�þ����ת��Ϊ��������������������ʵ���������£�

��1����֤����Һ�д���SO42����OH -��ѡ�õķ�������ȡ��������Һ�μ�________��������Һ��죬�������м���________��Һ�����ְ�ɫ���������֤��SO42����OH - �����ڡ�
��2�����ϴ��Mg(OH)2������___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ͼ���������

A. �������ᡢ�Ȼ�þ���Ȼ�������Һ����������������Һֱ������
B. �����ʯ��ˮ��ͨ�������̼����ֱ������
C. ���Ȼ�������Һ����������������Һֱ������
D. ���Ȼ�������Һ�����백ˮֱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᾧõ��߷�����֬M�ĺϳ�·����ͼ��ʾ��
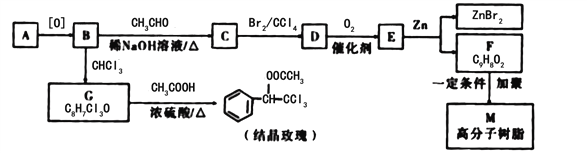
��֪:��A�DZ���ͬϵ��,����ͬ������,������������������ܶ�Ϊ46
��![]()
��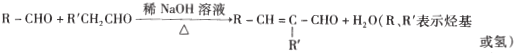
��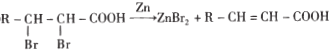
��1��C�к��������ŵ�����Ϊ______��E�Ľṹ��ʽΪ_____��
��2��д����G���ɽᾧõ��Ļ�ѧ����ʽ________________________________��
��3�������������С�C��D����M�ĺϳɹ����е�������___________________________
��4����֪G��һ��������ˮ������![]() ,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
a���Ȼ�����Һ������ɫ��Ӧ
b�����ϵ�һ��ȡ����ֻ��һ��
c������������������Һ��Ӧ,![]() ������
������![]() NaOH
NaOH
��5��E��ͬ���칹��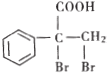 ��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ���绯ѧ���̵�ʾ��ͼ���ش��������⣺

(1)�׳���___________(�ԭ��ء��������ء���Ƴء�)װ�ã���װ���е缫A��������_______(�����������������������������������)��
(2)��װ����ͨ��CH4�ĵ缫��ӦʽΪ__________________________________����װ���е缫B(Ag)�ĵ缫��ӦʽΪ________________________________����װ����D���IJ�����____________(д��ѧʽ)��
(3)һ��ʱ�䣬�������в���112 mL(��״��)����ʱ�����Ƚ�����أ�������Һ��25 ��ʱ��pH��________(��֪��NaCl��Һ������������Һ���Ϊ500 mL)����Ҫʹ���ػָ����ǰ��״̬��Ӧ�������ͨ��________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҩ��ϳ��м���Ľṹ��ʽΪ �������йظ����ʵ�˵������ȷ������ ��
�������йظ����ʵ�˵������ȷ������ ��
A. ���ڷ����廯����
B. �ܷ�����ȥ��Ӧ����ԭ��Ӧ��������Ӧ�����ܷ���ˮ�ⷴӦ
C. 1 mol���л���������Na2CO3��Һ��Ӧ������2.5 mol Na2CO3
D. �ֱܷ������Na��NaOH��Һ��NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����
(1) 2017��10��22��,��ͨ�������������ۺ����������ṹ�ɹ�������
���Ŷս�����Ҫ�õ�����ˮ�ࡣ����ˮ�����Ҫԭ��Ϊ�����____(����ĸ)��
a. �����������������b. ʯ��ʯ����������������c. ʳ��

���ȶ�����Ϊ����֧��,�������ǽ��ſ�ṹ�ϵĺ��ش��ݸ���̨���ȶ�������____(����ĸ)��
a. ���ǽ�������
b. ��������
c. �л��߷��Ӳ���
������������Ҫʹ�ô����ֲ�,����Ԥ��ְ弰�ϡ��¸ְ�����ö�п�ְ�,�ְ��п����ҪĿ����____(����ĸ)��
a. �������� b. ���Ӳ�� c. �����ʴ��
(2)�����ǹ��ԡ��߲�֮�ʡ�������,����֬���������ʡ����ࡢά����A��ά����C�ͷḻ�ĸơ��ס�����Ԫ��,����:

������֬����ά���ص���____��
����������������Ԫ�ص���____��
��֬����������ˮ�����ɸ�֬�����____;������������ˮ������������,д���������������������Ļ�ѧ����ʽ: ____��
(3)����������Ȼ��Դ,��ֹ������Ⱦ����̬�ƻ���
����ȼú�м�������ʯ��ʯ,�ɴ�����______���ŷš�ú��������ʵ����Դ������Ҫ;��,ˮú������Ҫ�ɷ���CO��______��
��������һ�ֳ��õĻ�����,�侻ˮԭ����___________(�����ӷ���ʽ��ʾ)��
���ҹ���ѧ��֤���˻Ʒ۳���׳�ɽ���۱���ϩ(![]() )����������Ȼ��������ϡ���д���ɱ���ϩ�ϳɾ۱���ϩ�Ļ�ѧ����ʽ:________________�����η�������Ʒ��ɵİ�ɫ��Ⱦ,�����Բ��õķ�����:__________(��дһ��)��
)����������Ȼ��������ϡ���д���ɱ���ϩ�ϳɾ۱���ϩ�Ļ�ѧ����ʽ:________________�����η�������Ʒ��ɵİ�ɫ��Ⱦ,�����Բ��õķ�����:__________(��дһ��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com