
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
【答案】Al(OH)3 0.01 mol 15mL NaAlO2、NaCl 0.5mol·L-1 Al3++4OH-=![]() +2H2O
+2H2O
【解析】
本题是一道铝盐和碱反应的题目,只需牢牢抓住AlCl3+3NaOH===Al(OH)3↓+3NaCl和Al(OH)3+NaOH===NaAlO2+2H2O两个主要反应来分析即可,OA段沉淀质量在不断增加,因此是第一个反应,AB段沉淀质量开始减少,因此是AB段。
(1)向AlCl3溶液中滴加NaOH溶液时,先发生反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH===NaAlO2+2H2O,故A点沉淀为Al(OH)3,其物质的量为![]() =0.01 mol;
=0.01 mol;
(2)根据Al3++3OH-===Al(OH)3↓可知,反应至A点时消耗的n(NaOH)=3n[Al(OH)3]=0.01mol×3=0.03mol,消耗NaOH溶液的体积为![]() =0.015 L=15mL;
=0.015 L=15mL;
(3)根据AlCl3+3NaOH===Al(OH)3↓+3NaCl、Al(OH)3+NaOH===NaAlO2+2H2O可知,B点溶液中的溶质为NaAlO2、NaCl;
(4)c(AlCl3)=![]() =0.5 mol·L-1;
=0.5 mol·L-1;
(5)O点到B点总反应为Al3+转化为![]() 反应,总离子方程式为Al3++4OH-===
反应,总离子方程式为Al3++4OH-===![]() +2H2O。
+2H2O。


科目:高中化学 来源: 题型:
【题目】NA 表示阿伏加德罗常数的值。下列关于1 L 0. lmo/L FeCl3溶液的说法中正确的是
A.加热煮沸至溶液呈红褐色时,得到0. 1 NA Fe( OH)3 胶体粒子
B.室温下,加水稀释后,溶液中 c(OH- ) 减小
C.加入0. 3 mol KSCN 溶液,生成0. 1 mol Fe(SCN)3 的红色物质
D.加入0. 15 mol NaOH 固体后 ,3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
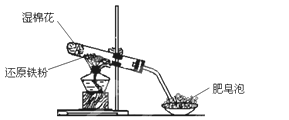
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
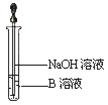
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重排反应是指某种化合物在试剂、温度或其他因素的影响下,发生分子中某些基团的转移或分子内碳原子骨架改变的反应。氢化偶氮苯(a)在一定条件下可重排为联苯胺(b),其变化如图所示。下列有关说法不正确的是

A.b分子中所有碳原子可能共平面B.a和b分子的一氯取代物数目相同
C.a和b均能发生氧化反应D.1mol a或b均能与6molH2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) H = +135 kJ mol-1 ,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) H =-41 kJ mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写岀碳和二氧化碳反应生成一氧化碳的热化学方程式_____。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。

若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的 物质的量之比为1:3,则反应②所对应的温度是_____(填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)2H2O(g)+4CO(g);CH4(g)+H2O(g)CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
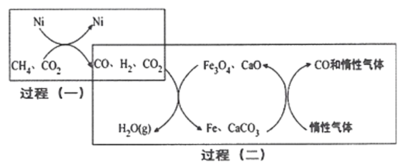
①过程(二)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(一)和过程(二)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(一)和过程(二)中均含有氧化还原反应
b.过程(二)中使用的催化剂为Fe3O4和CaCO3
C.若过程(一)投料比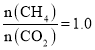 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____(用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____(用平衡分压代替平衡浓度计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从甜橙的芳香油中可分离得到如图结构的化合物,
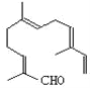
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能与该化合物中所有官能团都发生反应的试剂有( )
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。
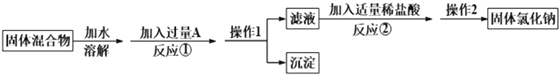
(1)操作1的名称是_____;
(2)反应①中加入略过量的A物质的目的是__________;
(3)写出反应②的化学方程式:_______。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g, 则样品中NaCl的质量分数是多少___?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO![]() +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________。
(4)请配平以下化学方程式:
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com