
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2·6H2O]制备K3[Fe(C2O4)3]·3H2O具体流程如图:
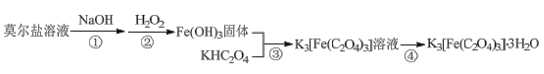
回答下列问题:
(1)步骤②滴加过量6%H2O2,生成红褐色胶状沉淀,该反应的化学方程式为___。生成的沉淀不易过滤,过滤前需要的操作是___。
(2)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制pH为3.5-4,若pH偏高应加入适量___(填“H2C2O4”或“K2C2O4”)。
(3)步骤④的操作是___、过滤。得到的晶体依次用少量冰水、95%乙醇洗涤,用95%乙醇洗涤的目的是___。
(4)测定K3[Fe(C2O4)3]·3H2O中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定反应的氧化产物为___。滴定时,盛放高锰酸钾溶液的仪器是___(“酸式”或“碱式”)滴定管。
②向上述溶液中加入过量锌粉至将铁元素全部还原为Fe2+后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该样品中铁的质量分数的表达式为___。
【答案】2Fe(OH)2+H2O2==2Fe(OH)3 煮沸 H2C2O4 蒸发浓缩、冷却结晶 除去晶体表面的水分 CO2 酸式 ![]()
【解析】
莫尔盐[(NH4)2Fe(SO4)2·6H2O]中加入NaOH,发生的反应①为Fe2+与OH-反应生成Fe(OH)2;加入H2O2,发生反应②为Fe(OH)2与H2O2反应生成Fe(OH)3;在反应③中,Fe(OH)3固体与KHC2O4反应,生成K3[Fe(C2O4)3]溶液;将溶液蒸发结晶便可得到K3[Fe(C2O4)3]·3H2O晶体,再洗涤干燥,从而获得纯净的晶体。
(1)步骤②滴加过量6%H2O2,将Fe(OH)2氧化为Fe(OH)3红褐色胶状沉淀,该反应的化学方程式为2Fe(OH)2+H2O2==2Fe(OH)3。生成的沉淀呈胶状,不易过滤,过滤前需要加热煮沸以破坏其胶状结构,操作是煮沸。答案为:2Fe(OH)2+H2O2==2Fe(OH)3;煮沸;
(2)步骤③若pH偏高,则应加酸将pH降低,所以应加入适量H2C2O4。答案为:H2C2O4;
(3)步骤④是从溶液中提取溶质,操作是蒸发浓缩、冷却结晶、过滤。得到的晶体依次用少量冰水、95%乙醇洗涤,因结晶水合物受热易失去结晶水,所以用95%乙醇洗涤,目的是除去晶体表面的水分,防止晶体受热失去结晶水。答案为:蒸发浓缩、冷却结晶;除去晶体表面的水分;
(4)①滴定时,H2C2O4被氧化生成CO2,反应的氧化产物为CO2。滴定时,因高锰酸钾会腐蚀橡皮管,所以盛放高锰酸钾溶液的仪器是酸式滴定管。答案为:CO2;酸式;
②Fe3+被Zn还原为Fe2+,Fe2+被KMnO4氧化生成Fe3+,关系式为5Fe3+——5Fe2+——KMnO4,则n(Fe3+)=cmol·L-1×V×10-3L×5=5×10-3cVmol,该样品中铁的质量分数的表达式为![]() =
=![]() 。答案为:
。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,往 H3PO4 溶液中滴加 NaOH 溶液,体系中含磷各物种所占的物质的量分数 (α)随溶液pH 变化的关系如图所示。下列有关说法不正确的是
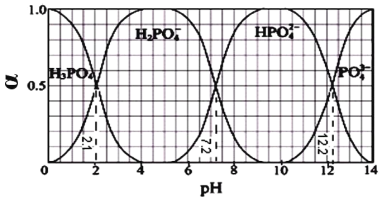
A.为尽可能得到较纯的 NaH2PO4,pH 应控制在 4~5.5 左右
B.在 pH<7.2 的溶液中,c (H2PO4 - )>c (HPO42 -)
C.当 pH=7.2 时,H2PO4 - 与 HPO42 -的物质的量相等且等于原溶液磷酸物质的量的一半
D.pH=13 时,溶液中各微粒浓度大小关系为:c (Na+)>c (PO43-)>c (HPO42-)>c (OH-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合 H+能力的相对强弱:H2O_____NH3 (填“>”、“<”或“=”);用一个离子 方程式说明 H3O+和 NH4+给出 H+能力的相对强弱_____。
(2)NaOCN 是离子化合物,各原子均满足 8 电子稳定结构。写出 NaOCN 的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为 120g·mol-1,从结构上 分析其可能的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
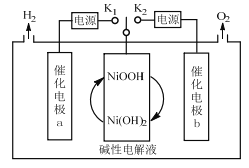
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
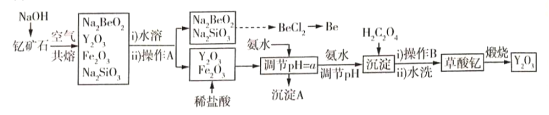
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气)![]() NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气)![]() H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
A.3.5mol/LB.4.5mol/LC.4mol/LD.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是()
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-)
B.相同质量的钠分别完全转化为Na2O和Na2O2时转移的电子数
C.相同物质的量的丙烷和2-甲基丙烷中所含C-H键的数目
D.标准状况下,相同体积的乙炔和苯中所含的H原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
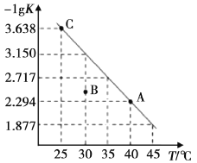
A.C点对应状态的平衡常数K(C)=10-3.638
B.该反应的ΔH>0
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com