
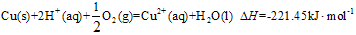

 ��һ�������£�SO2��ƽ��ת���ʺ��¶ȵĹ�ϵ��ͼ��ʾ���÷�Ӧ�Ħ�H _______0�����������������Ӧ���е�״̬Dʱ��v��________ v�棨���������������=������?
��һ�������£�SO2��ƽ��ת���ʺ��¶ȵĹ�ϵ��ͼ��ʾ���÷�Ӧ�Ħ�H _______0�����������������Ӧ���е�״̬Dʱ��v��________ v�棨���������������=������? 
 2SO3(g)��ƽ�ⳣ��K=_________��
2SO3(g)��ƽ�ⳣ��K=_________�� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
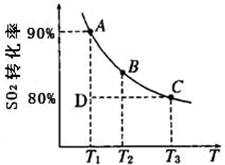 ���仯�����ڹ���������ռ����Ҫ�ĵ�λ��
���仯�����ڹ���������ռ����Ҫ�ĵ�λ��| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?�Ͳ�һģ�����仯�����ڹ���������ռ����Ҫ�ĵ�λ��
��2012?�Ͳ�һģ�����仯�����ڹ���������ռ����Ҫ�ĵ�λ��| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com