
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(2) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为__________。
(3) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(4) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
【答案】 < CO32->SO32- >CH3COO->HSO3- ①>②=③ CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol
CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol
【解析】(1). 根据表中数据可知,醋酸的酸性小于亚硫酸,pH相同的醋酸和亚硫酸稀释相同倍数后,亚硫酸的pH变化大,即:醋酸的pH小于亚硫酸,故答案为:<;
(2). 由表中数据可知,酸性强弱顺序为:H2SO3>CH3COOH>H2CO3>HSO3>HCO3,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO、CO32、HSO3、SO32在溶液中结合H+的能力由大到小的关系为:CO32->SO32- >CH3COO->HSO3-,故答案为:CO32->SO32- >CH3COO->HSO3-;
(3). c(H+)相同的盐酸和硫酸中和碱的能力相同,而c(H+)相同的盐酸和醋酸,因为醋酸是弱电解质,则醋酸中和碱的能力强,所以消耗NaOH溶液的体积由大到小的排列顺序为:①>②=③,故答案为:①>②=③;
(4). 实验测得稀醋酸与稀NaOH溶液反应生成1molH2O时放出57kJ的热量,则热化学方程式为:CH3COOH(aq)+OH(aq)=H2O(l)+CH3COO(aq) △H=57.0kJ/mol,令该反应为①式, H+(aq)+OH(aq)=H2O(l) △H=57.3kJ/mol,令该反应为②式,则根据盖斯定律,①②得:CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol,故答案为:CH3COOH(aq)
CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol,故答案为:CH3COOH(aq) ![]() CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol。
CH3COO-(aq) + H+(aq) ΔH=+0.3 kJ/mol。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】己二酸是一种重要的化工原料和合成中间体。已知:室温下,己二酸微溶于水,当温度由28℃升至78℃时,其溶解度可增大20倍。某实验小组利用绿色氧化剂H2O2氧化环己烯合成己二酸,反应和制备装置如下:
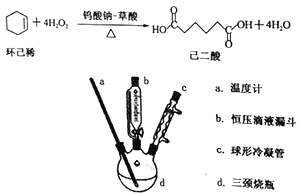
主要实验步骤:
①在100mL三颈烧瓶中依次加入1.50g钨酸钠0.57g草酸和34mL30%过氧化氢溶液,室温下磁力搅拌20min。
②用恒压滴液漏斗缓慢加入8.0mL的环己烯,继续搅拌并加热回流2小时,停止加热。
③将反应液迅速转入烧杯中,冷却至室温后再用冰水浴冷却,有大量晶体析出。抽滤,并用少量冰水洗涤,即可得到己二酸晶体粗品。
回答下列问题:
(1)本实验中使用带刻度的恒压滴液漏斗的主要作用有_________、_________。
(2)步骤③中用冰水洗涤晶体的目的是______________________________________。
己二酸晶体粗品可利用_________方法进一步获得纯品。
(3)取0.1480g己二酸(Mr=146.0)样品置于250mL锥形瓶中,加入50mL蒸馏水溶解,再加入2滴指示剂,用0.1000mol/Ld的NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为20.00mL。
①本实验应选择_________(填“甲基橙”“石蕊”或“酚酞”)溶液作指示剂。
②判断滴定终点的方法是_________________________。
③样品中己二酸的质量分数为_________%(保留4位有效数字)。
(4)实验小组通过改变环己烯的用量来探究物料比对产率的影响,实验结果如下图所示。
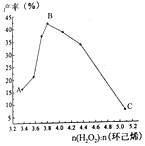
结合图像分析产率变化的可能原因:
①A点→B点:___________________________________________;
②B点→C点:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
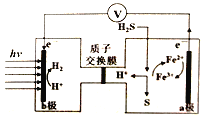
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,
② H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是( )
A. 氢氟酸的电离方程式及热效应可表示为:HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:

(1)从“除质2”后的溶液中得到MnSO4的操作为______、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①__________;②__________。提高软锰矿浸出率的措施还有______和_______。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______,加入其目的是_________。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
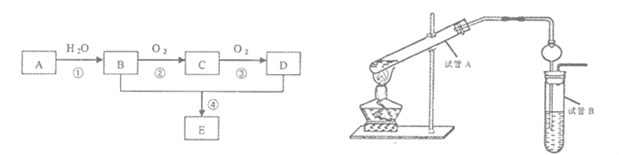
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学方程式书写正确的是
A. CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. ![]() +HO-NO2
+HO-NO2![]()
![]() -NO2+H2O
-NO2+H2O
C. H2C=CH2+Br2![]() CH3CHBr2
CH3CHBr2
D. CH3CH2OH+CH3COOH![]() CH3CH2COOCH3+H2O
CH3CH2COOCH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是

A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. 醋酸的电离:CH3COOH+H2O![]() CH3COO-+H3O+
CH3COO-+H3O+
B. Al(OH)3通氨水:Al(OH)3+4NH3·H2O![]() [Al(NH3)4]3++3OH-+4H2O
[Al(NH3)4]3++3OH-+4H2O
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. BaSO4的电离方程式:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com